NEJM – Một cách tiếp cận dựa trên bằng chứng để tiêm vaccine phòng Covid-19
Tác giả Vinay Prasad, M.D., M.P.H., and Martin A. Makary, M.D., M.P.H
Trong 5 năm qua, Hoa Kỳ đã chuyển sang chương trình tăng cường vaccine Covid-19 hàng năm. Mỗi mùa thu, các mũi tiêm tăng cường vắc-xin Covid-19 được phát triển, cùng với vaccine cúm theo mùa, và được khuyến nghị cho mọi người dân Mỹ. So với các chính sách tiêm chủng ở tất cả các quốc gia châu Âu, chính sách của Hoa Kỳ là tích cực nhất. Trong khi tất cả các quốc gia thu nhập cao khác giới hạn các khuyến nghị về vaccine cho người lớn tuổi (thường là những người trên 65 tuổi) hoặc những người có nguy cơ cao mắc Covid-19 nghiêm trọng, Hoa Kỳ đã áp dụng khuôn khổ quản lý một kích thước phù hợp với tất cả và đã cấp phép tiếp thị rộng rãi cho tất cả người Mỹ trên 6 tháng tuổi. Chính sách của Hoa Kỳ đôi khi được biện minh bằng lập luận rằng người dân Mỹ không đủ tinh tế để hiểu các khuyến nghị dựa trên độ tuổi và rủi ro. Các tác giả đã bác bỏ quan điểm này.
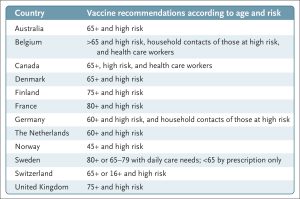
Mặc dù sự phát triển nhanh chóng của nhiều loại vaccine Covid-19 vào năm 2020 là một thành tựu khoa học, y tế và quản lý lớn, nhưng lợi ích của việc tiêm nhắc lại — đặc biệt là đối với những người có nguy cơ thấp, những người có thể đã từng tiêm nhiều liều vaccine Covid-19, đã từng bị nhiễm Covid-19 nhiều lần hoặc cả hai — vẫn chưa chắc chắn. Người dân Mỹ, cùng với nhiều nhân viên y tế, vẫn chưa bị thuyết phục.
Theo Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC), trong hai mùa qua, tỷ lệ tiêm nhắc lại vaccine Covid-19 hàng năm rất thấp. Dưới 25% người Mỹ được tiêm nhắc lại mỗi năm, dao động từ dưới 10% trẻ em dưới 12 tuổi trong mùa 2024–2025 đến 50% người lớn trên 75 tuổi. Ngay cả những nhân viên y tế vẫn còn do dự, với chưa đến một phần ba tham gia chương trình tiêm nhắc lại vào mùa thu năm 2023–2024. Thậm chí có thể có hiệu ứng lan tỏa: niềm tin của công chúng vào việc tiêm chủng nói chung đã giảm, dẫn đến tình trạng miễn cưỡng tiêm vaccine đang ảnh hưởng đến cả các chương trình tiêm chủng quan trọng như vaccine sởi-quai bị-rubella (MMR), vốn đã được xác định rõ ràng là an toàn và có hiệu quả cao.
Trong những năm gần đây, tỷ lệ tiêm chủng MMR giảm đã trở thành mối quan tâm ngày càng tăng và góp phần gây ra bệnh tật nghiêm trọng và tử vong do bệnh sởi. Trong bối cảnh này, Cục Quản lý Thực phẩm và Dược phẩm (FDA) tìm cách cung cấp hướng dẫn và thúc đẩy việc tạo ra bằng chứng.
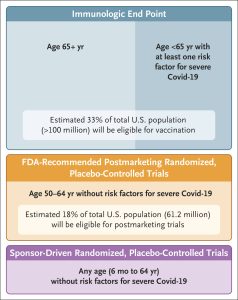
Tiến về phía trước, FDA sẽ áp dụng khuôn khổ quản lý vaccine Covid-19 sau đây: Trên cơ sở tính sinh miễn dịch — bằng chứng cho thấy vaccine có thể tạo ra nồng độ kháng thể ở người — FDA dự đoán rằng họ sẽ có thể đưa ra những phát hiện có lợi ích – rủi ro thuận lợi cho người lớn trên 65 tuổi và tất cả những người trên 6 tháng tuổi có một hoặc nhiều yếu tố nguy cơ khiến họ có nguy cơ cao mắc các kết cục nghiêm trọng của Covid-19, như CDC mô tả. Đối với tất cả những người khỏe mạnh — những người không có yếu tố nguy cơ mắc Covid-19 nghiêm trọng — trong độ tuổi từ 6 tháng đến 64, FDA dự đoán cần có dữ liệu thử nghiệm có đối chứng ngẫu nhiên đánh giá các kết cục lâm sàng trước khi có thể cấp Giấy phép sản phẩm sinh học. Trong khả năng có thể, khi phê duyệt vaccine Covid-19 cho các nhóm có nguy cơ cao, FDA sẽ khuyến khích các nhà sản xuất tiến hành các thử nghiệm có đối chứng ngẫu nhiên trên quần thể người lớn khỏe mạnh như một phần trong cam kết sau khi đưa vaccine ra thị trường.
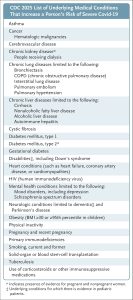
Tiêu chí chính được FDA ưa thích trong các thử nghiệm này sẽ là Covid-19 có triệu chứng, đặc biệt chú ý đến một số tiêu chí phụ: Covid-19 nặng, nhập viện và tử vong. Các tính toán về quy mô mẫu nên hướng đến mục tiêu chứng minh rằng vắc-xin làm giảm tỷ lệ mắc tiêu chí chính với khoảng tin cậy thấp hơn, lý tưởng nhất là trên 30%. Những người đã mắc Covid-19 trong năm qua không nên bị loại trừ — vì cần có bằng chứng đối với người Mỹ trung bình. Việc theo dõi nên kéo dài tối thiểu 6 tháng để đảm bảo rằng những lợi ích từ mũi tăng cường sớm vẫn tiếp tục. Nhóm đối chứng có thể được dùng giả dược nước muối để cho phép ghi lại toàn bộ hồ sơ tác dụng phụ. Cuối cùng, chỉ riêng những nghiên cứu này cũng có thể đảm bảo rằng chiến lược tiêm nhắc lại mũi tăng cường vĩnh viễn của người Mỹ là có bằng chứng.
Cần lưu ý rằng chính sách của FDA cân bằng các giá trị cạnh tranh. Đầu tiên, việc chúng tôi chấp nhận các điểm cuối miễn dịch đảm bảo rằng chúng tôi có thể cung cấp sự chấp thuận kịp thời cho một nhóm dân số rộng lớn. Phạm vi các bệnh trong định nghĩa của CDC về nguy cơ cao mắc bệnh nghiêm trọng là rất lớn, bao gồm béo phì và thậm chí cả các tình trạng sức khỏe tâm thần như trầm cảm.
Ước tính cho thấy rằng 100 triệu đến 200 triệu người Mỹ sẽ được tiếp cận với vaccine theo cách này.
Thứ hai, chính sách của chúng tôi cũng cân bằng nhu cầu về bằng chứng. Chúng tôi chỉ đơn giản là không biết liệu một phụ nữ 52 tuổi khỏe mạnh có BMI bình thường, đã mắc Covid-19 ba lần và đã tiêm sáu liều vaccine Covid-19 trước đó có được hưởng lợi từ liều thứ bảy hay không. Chính sách này sẽ thúc đẩy việc tạo ra bằng chứng rất cần thiết. Thứ ba, nghiên cứu hậu tiếp thị được đề xuất của chúng tôi không loại trừ việc tiến hành các nghiên cứu ngẫu nhiên bổ sung, đặc biệt là các nghiên cứu ở nhóm dân số nhi khoa. Đáng chú ý là bằng chứng hiện tại cho thấy nguy cơ cao hơn ở trẻ rất nhỏ (<4 tuổi) so với trẻ lớn hơn; tuy nhiên, những rủi ro này vẫn thấp hơn so với những rủi ro ở người lớn từ 65 tuổi trở lên và ngang bằng với những rủi ro ở người lớn từ 50 đến 64 tuổi, một khu vực cân bằng toàn cầu. Như thường lệ, FDA sẽ đánh giá các hồ sơ đăng ký riêng lẻ trên cơ sở từng trường hợp cụ thể và sẽ đánh giá sự cân bằng lợi ích-rủi ro của mỗi lần nộp đơn xin cấp phép.
🍀Covid-19 khác với cúm ở một số điểm.
Đầu tiên, virus SARS-CoV-2 đã trải qua quá trình tiến hóa đột biến khác với virus cúm; khả năng miễn dịch do vaccine Covid tạo ra có thể không cần cập nhật hàng năm để có kết quả sức khỏe có ý nghĩa lâm sàng nhất nhưng có thể được kích hoạt bởi sự thay đổi kháng nguyên đáng kể.
Thứ hai, Covid-19 có khả năng lây truyền vào mùa hè, có thể tạo điều kiện thuận lợi cho việc tiến hành các nghiên cứu ngẫu nhiên tiếp tục áp dụng trong các khoảng thời gian trong tương lai.
Thứ ba, khả năng miễn dịch tự nhiên từ Covid-19 chống lại bệnh nặng có vẻ mạnh mẽ.
Triết lý Covid-19 mới của FDA thể hiện sự cân bằng giữa tính linh hoạt trong quy định và cam kết về khoa học tiêu chuẩn vàng. FDA sẽ phê duyệt vaccine cho những người có nguy cơ cao và đồng thời yêu cầu dữ liệu tiêu chuẩn vàng mạnh mẽ về những người có nguy cơ thấp.
Những thử nghiệm lâm sàng này sẽ cung cấp thông tin về định hướng tương lai cho FDA, nhưng quan trọng hơn là chúng sẽ cung cấp thông tin mà các nhà cung cấp dịch vụ chăm sóc sức khỏe và người dân Mỹ đang rất mong muốn.
Trích DOI: 10.1056/NEJMsb2506929