The Lancet – Các mô hình điều trị toàn thân mới trong ung thư đường mật tiến triển và sự khác biệt trong khả năng tiếp cận của bệnh nhân trên khắp Châu Âu
Lorenza Rimassaa, Angela Lamarca, Grainne M. O’Kaned, Julien Edelinef, Mairéad G. McNamarag ∙ Arndt Vogelh, et al.
Tóm tắt
Trong những năm gần đây, các lựa chọn điều trị cho bệnh nhân ung thư đường mật (biliary tract cancer BTC) tiến triển đã tăng đáng kể do kết quả tích cực từ các thử nghiệm lâm sàng giai đoạn 2/3 về thuốc ức chế điểm kiểm soát miễn dịch, kết hợp với hóa trị liệu và các tác nhân nhắm mục tiêu phân tử.
Những tiến bộ này đã dẫn đến nhu cầu xét nghiệm phân tử để xác định những thay đổi có thể thực hiện được và những bệnh nhân có thể tiếp nhận liệu pháp nhắm mục tiêu.
Tuy nhiên, những cải tiến này đã mang đến nhiều câu hỏi và thách thức, bao gồm việc xác định cơ chế kháng thuốc và trình tự điều trị. Trong bài báo cáo của Series này, các tác giả muốn cung cấp tổng quan về các lựa chọn điều trị toàn thân hiện tại cho bệnh nhân mắc BTC, nêu bật sự chênh lệch trong khả năng tiếp cận các phương pháp điều trị tiên tiến và xét nghiệm phân tử trên khắp các quốc gia châu Âu, dẫn đến sự bất bình đẳng trong khả năng điều trị cho bệnh nhân mắc BTC tiến triển. Họ cũng thảo luận về cách các dự án hợp tác đang diễn ra của châu Âu, chẳng hạn như COST Action Precision-BTC-Network CA22125, được COST (Hợp tác khoa học và công nghệ châu Âu) hỗ trợ, liên kết với Mạng lưới nghiên cứu ung thư đường mật châu Âu (European Network for the Study of Cholangiocarcinoma ENSCCA), có thể giúp khắc phục những chênh lệch này và cải thiện tình hình hiện tại.
Giới thiệu
Hóa trị từ lâu đã là phương pháp điều trị toàn thân chính cho bệnh nhân ung thư đường mật tiến triển (BTC), dựa trên dữ liệu giai đoạn 3.
Thử nghiệm ABC-02 đã chứng minh rằng sự kết hợp của cisplatin và gemcitabine (CisGem) cải thiện kết quả so với gemcitabine tác nhân đơn lẻ,1 và thử nghiệm ABC-06 cho thấy lợi ích của sự kết hợp của axit folinic, 5-fluorouracil (5-FU) và oxaliplatin (mFOLFOX) so với kiểm soát triệu chứng tích cực sau CisGem.
Thông điệp chính
🍀Điều trị BTC tiến triển đã được cải thiện đáng kể trong những năm gần đây với hơn mười liệu pháp mới, nhưng việc hoàn trả của chúng khác nhau ở khắp Châu Âu
🍀Việc lập hồ sơ phân tử rất quan trọng để xác định những thay đổi có thể thực hiện được và xác định lộ trình điều trị chính xác; việc xác định các cơ chế kháng thuốc và trình tự điều trị vẫn đang là thách thức đối với sự chênh lệch đáng kể trong các hệ thống chăm sóc sức khỏe và việc hoàn trả dẫn đến sự bất bình đẳng trong việc tiếp cận các phương pháp điều trị tiên tiến và xét nghiệm phân tử trên khắp các quốc gia Châu Âu. Cần có sự hợp tác quốc tế để điều hòa các quy trình tiếp cận và phê duyệt điều trị
🍀Điều cần thiết là các bên liên quan và cơ quan chính phủ khác nhau phải nhận thức được những thách thức này và vận động để thúc đẩy thay đổi chính sách và khắc phục những bất bình đẳng này.
Chiến lược tìm kiếm và tiêu chí lựa chọn
Tài liệu tham khảo cho bài báo Series này được xác định thông qua tìm kiếm trên PubMed với các thuật ngữ tìm kiếm “biliary cancer”, “treatment”, “genomic profiling” từ năm 2010 đến năm 2024. Các bài báo cũng được xác định thông qua tìm kiếm trong các tệp của chính tác giả. Chỉ các bài báo được xuất bản bằng tiếng Anh mới được xem xét. Danh sách tài liệu tham khảo cuối cùng được tạo ra trên cơ sở tính nguyên bản và sự liên quan đến phạm vi rộng của bài báo Series này.
Gần đây, các lựa chọn điều trị mới, chẳng hạn như thuốc ức chế điểm kiểm soát miễn dịch (ICI) và các tác nhân nhắm mục tiêu phân tử, đã cải thiện kết quả trong khi vẫn duy trì chất lượng cuộc sống ở những bệnh nhân mắc BTC tiến triển. Hai thử nghiệm giai đoạn 3 đã chứng minh rằng sự kết hợp của CisGem với ICI, durvalumab hoặc pembrolizumab, đã cải thiện khả năng sống sót so với CisGem. Hơn nữa, việc phát hiện ra các biến đổi bộ gen đã mở đường cho y học chính xác và sự xuất hiện của các tác nhân nhắm mục tiêu phân tử đang nhanh chóng thay đổi phương pháp điều trị cho những bệnh nhân mắc BTC.
Các nghiên cứu giai đoạn 2 và 3 đã chỉ ra lợi ích của pemigatinib và futibatinib đối với bệnh nhân có sự hợp nhất/sắp xếp lại gen FGFR2, và của ivosidenib đối với bệnh nhân có đột biến IDH1 trước đó đã được điều trị bằng hóa trị liệu, trong khi các nghiên cứu giai đoạn 1/2 khác đã xác định thêm các lựa chọn điều trị cho bệnh nhân có các biến đổi phân tử khác.
Tuy nhiên, những kết quả tích cực này đã đặt ra nhiều câu hỏi và thách thức, bao gồm việc xác định các cơ chế kháng thuốc và trình tự điều trị. Cơ quan Dược phẩm Châu Âu (EMA) đã phê duyệt durvalumab và pembrolizumab kết hợp với CisGem để điều trị tuyến đầu cho bệnh nhân mắc BTC; pemigatinib, futibatinib và ivosidenib cho bệnh nhân đã được điều trị trước đó có các biến đổi phân tử thích hợp; và các phê duyệt không xác định bổ sung cho các liệu pháp nhắm mục tiêu có liên quan đến bệnh nhân mắc BTC.
Tuy nhiên, khả năng tiếp cận các loại thuốc này không đồng đều trong Châu Âu và sự khác biệt trong hệ thống chăm sóc sức khỏe giữa các quốc gia Châu Âu dẫn đến sự chênh lệch đáng kể trong các phương pháp điều trị có sẵn cho những bệnh nhân này.
Trong bài báo này, các tác giả cung cấp tổng quan về các phương pháp điều trị toàn thân hiện tại cho bệnh nhân mắc BTC và nêu bật những cải tiến và sửa đổi gần đây của các hướng dẫn. Nhóm NC cũng đã tiến hành một cuộc khảo sát trên 47 bác sĩ châu Âu về việc triển khai các công nghệ và thuốc mới.
Cuộc khảo sát bao gồm 24 câu hỏi và được gửi đến các đồng tác giả của bản thảo này và các chuyên gia chủ chốt khác tham gia vào việc quản lý bệnh nhân mắc BTC.
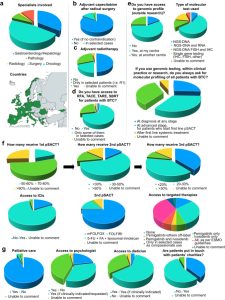
Những người tham gia bao gồm các bác sĩ ung thư (n = 22), bác sĩ gan/tiêu hóa (n = 16), bác sĩ phẫu thuật (n = 5), bác sĩ giải phẫu bệnh (n = 3) và bác sĩ X quang (n = 1). 36 tổ chức được đại diện trên 18 quốc gia (Hình 1 và Tài liệu bổ sung, Bảng S1). Chúng tôi đã xác định những thách thức trong việc tiếp cận các liệu pháp tiên tiến ở các quốc gia châu Âu, nhấn mạnh nhu cầu giải quyết bất bình đẳng và trình bày các dự án đang diễn ra của châu Âu nhằm cải thiện tình hình hiện tại.
Hình 1 Kết quả khảo sát về thực hành lâm sàng trong ung thư đường mật ở Châu Âu. Bảng a cung cấp thông tin về những người tham gia khảo sát (n = 47 bác sĩ). Nếu có nhiều hơn một bác sĩ từ một quốc gia cụ thể trả lời khảo sát, số lượng người tham gia chính xác từ quốc gia đó sẽ được báo cáo trên bản đồ. Các câu trả lời liên quan đến khả năng tiếp cận các liệu pháp toàn thân và tại chỗ được báo cáo trong các bảng b, c, d và f; các câu trả lời liên quan đến khả năng tiếp cận hồ sơ bộ gen được báo cáo trong bảng e. Bảng g cung cấp thông tin liên quan đến khả năng tiếp cận dịch vụ chăm sóc hỗ trợ. Tất cả các câu trả lời được cung cấp trong các bảng b, c, d, e, f và g được phân chia theo tổ chức (n = 36). Từ viết tắt: 5-FU, 5-fluorouracil; BTC, ung thư đường mật; ESMO, Hiệp hội Ung thư Nội khoa Châu Âu; FA, axit folinic; FISH, lai tạo huỳnh quang tại chỗ; FOLFIRI, axit folinic + 5-FU + irinotecan; FOLFOX, axit folinic + 5-FU + oxaliplatin; ICI, chất ức chế điểm kiểm soát miễn dịch; IHC, miễn dịch mô hóa học; NGS, giải trình tự thế hệ tiếp theo; pSACT, điều trị chống ung thư toàn thân giảm nhẹ; RFA, cắt bỏ bằng sóng cao tần; SBRT, xạ trị định vị thân; TACE, hóa chất tắc mạch xuyên động mạch; TARE, phóng xạ tắc mạch xuyên động mạch. Được tạo bằng Adobe Illustrator.
Hóa trị để điều trị BTC tiến triển
Cho đến gần đây, CisGem là lựa chọn hàng đầu tiêu chuẩn trong BTC tiến triển không thể cắt bỏ hoặc di căn. Thử nghiệm ABC-02 đã chứng minh thời gian sống sót chung (OS) trung bình là 11,7 tháng với CisGem so với 8,1 tháng chỉ dùng gemcitabine.1 Những nỗ lực cải thiện kết quả sống sót bằng phác đồ hóa trị ba thuốc đều không thành công ở các quần thể phương Tây.17–20 Cả thử nghiệm PRODIGE 38 AMEBICA về mFOLFIRINOX và thử nghiệm SWOG1815 về CisGem và paclitaxel gắn albumin đều không cho thấy sự cải thiện về OS so với CisGem,17–19 mặc dù trong nghiên cứu sau đó, những bệnh nhân mắc bệnh tiến triển tại chỗ và ung thư túi mật (GBC) dường như được hưởng lợi từ phác đồ ba thuốc.
Thử nghiệm giai đoạn 3 ngẫu nhiên KHBO1401-MITSUBA của Nhật Bản đã ghi nhận tỷ lệ đáp ứng khách quan (ORR) cao hơn (41% so với 15%) và cải thiện OS trung bình (13,5 so với 12,6 tháng) khi so sánh CisGem/S1 với CisGem đơn độc; đáng chú ý là hai phần ba bệnh nhân bị GBC hoặc ung thư đường mật ngoài gan (eCCA). Tại các quốc gia mà việc bổ sung ICI vẫn chưa được chấp thuận và hoàn trả, CisGem vẫn là phác đồ điều trị tiêu chuẩn đầu tiên.
Sau khi tiến triển trong liệu pháp điều trị đầu tiên, khi không có những thay đổi có thể nhắm mục tiêu, hóa trị liệu tuyến hai đã được chứng minh là cải thiện khả năng sống sót và có thể được cân nhắc ở những bệnh nhân vẫn khỏe mạnh.22 Thử nghiệm ABC-06 là nghiên cứu giai đoạn 3 phân nhóm ngẫu nhiên những bệnh nhân đã tiến triển trên CisGem sang mFOLFOX so với kiểm soát triệu chứng tích cực.2 Nghiên cứu này cho thấy lợi ích OS với hóa trị liệu (OS trung bình là 6,2 tháng so với 5,3 tháng). Thời gian sống không tiến triển trung bình (PFS) là 4 tháng, với tỷ lệ đáp ứng một phần là 5%. Mặc dù có lợi ích khiêm tốn, chất lượng cuộc sống không bị xấu đi ở nhóm hóa trị, do đó, đây được coi là phương pháp điều trị an toàn trong bối cảnh này. Tuy nhiên, không có dấu ấn sinh học nào để lựa chọn bệnh nhân cho mFOLFOX và tất cả bệnh nhân dường như đều được hưởng lợi như nhau, bất kể phản ứng với bạch kim trước đó hay tình trạng của các gen liên quan đến sửa chữa tổn thương DNA.
Sự kết hợp của 5-FU và irinotecan liposome đã được nghiên cứu như một giải pháp thay thế tiềm năng cho mFOLFOX. Tuy nhiên, đã có báo cáo về các kết quả trái ngược nhau. Đầu tiên, thử nghiệm ngẫu nhiên giai đoạn 2 của NIFTY tại Hàn Quốc đã báo cáo về OS được cải thiện so với chỉ dùng 5-FU (8,6 tháng so với 5,3 tháng); PFS tương tự (4,2 tháng) so với PFS được báo cáo cho mFOLFOX trong thử nghiệm ABC-06.25,26 Ngược lại, thử nghiệm NALIRICC của Đức, với thiết kế nghiên cứu tương tự, đã không đạt được ý nghĩa: OS trung bình là 8,2 tháng so với 6,9 tháng và PFS trung bình là 2,6 tháng so với 2,3 tháng. Trong cả hai nghiên cứu, ORR xấp xỉ 12–14%.
Dựa trên các dữ liệu này, các hướng dẫn khuyến nghị mFOLFOX khi không có thay đổi có thể nhắm mục tiêu. Ở những bệnh nhân được chọn có chống chỉ định với mFOLFOX, 5-FU và irinotecan có thể được coi là lựa chọn thay thế, mặc dù không có dữ liệu đáng tin cậy nào hỗ trợ điều này.
Theo khảo sát của chúng tôi, hóa trị liệu được tiếp cận rộng rãi ở nhiều quốc gia khác nhau tại Châu Âu. Trong bối cảnh tuyến đầu, CisGem được tiếp cận rộng rãi, với hơn 80% các cơ sở cũng có thể tiếp cận ICI. Tuy nhiên, điều thú vị cần lưu ý là nhiều bệnh nhân không đủ điều kiện để bắt đầu điều trị chống ung thư toàn thân giảm nhẹ tuyến đầu (pSACT), với hầu hết các cơ sở kê đơn pSACT tuyến đầu cho chưa đến 70% bệnh nhân được chẩn đoán mới mắc BTC không thể cắt bỏ, cho thấy có phạm vi cải thiện chăm sóc hỗ trợ khi chẩn đoán. Trong bối cảnh tuyến thứ hai, thông lệ hiện tại nhấn mạnh rằng ở 70% các cơ sở, chưa đến 50% bệnh nhân mắc BTC được điều trị pSACT tuyến thứ hai do tình trạng hoạt động của họ suy giảm nhanh chóng. Điều quan trọng là các số liệu trong khảo sát của chúng tôi phù hợp với dữ liệu đã công bố trước đây. Trong hai phân tích về cơ sở dữ liệu nhập viện trên toàn quốc của Pháp, bao gồm 3650 bệnh nhân mắc CCA trong gan (iCCA)28 và 19.825 bệnh nhân mắc BTC, chỉ có 812 (22%) bệnh nhân và 7721 (38,9%) bệnh nhân được điều trị bằng pSACT.29 mFOLFOX đại diện cho tiêu chuẩn chăm sóc chủ yếu ở Châu Âu và tại 75% các cơ sở, bác sĩ kê đơn thuốc này thay vì FOLFIRI hoặc irinotecan/5-FU dạng liposome (Hình 1).
🌏EMA đã chấp thuận các phối hợp hóa miễn dịch trị liệu ở tuyến đầu
Việc sử dụng ICI để điều trị BTC tiến triển đã được nghiên cứu. Ngoại trừ nhóm nhỏ bệnh nhân có khối u bất ổn vi vệ tinh cao (MSI-H), kết quả của các tác nhân đơn lẻ chống lại cái chết được lập trình-1 (PD-1) là đáng thất vọng (ORR 3–13%).30–32 Tuy nhiên, kết quả của việc kết hợp với hóa trị liệu như phương pháp điều trị tuyến đầu hứa hẹn hơn. Trong một thử nghiệm giai đoạn 2 tại Hàn Quốc thử nghiệm các phác đồ hóa trị liệu khác nhau cộng với durvalumab [một kháng thể chống lại phối tử cái chết được lập trình-1 (PD-L1)] có hoặc không có tremelimumab (một kháng thể kháng tế bào lympho T gây độc tế bào kháng nguyên-4), ORR dao động từ 50% đến 72% và OS trung bình từ 24,2 đến 26,6 tháng.
TOPAZ-1 là một thử nghiệm giai đoạn 3, so sánh sự kết hợp của CisGem với durvalumab so với CisGem với giả dược trong bối cảnh tuyến đầu. Tiêu chí chính về OS đã đạt được, với OS trung vị là 12,9 so với 11,3 tháng.3,4 Tiêu chí phụ về PFS (7,2 tháng so với 5,2 tháng) và ORR (27% so với 19%) cũng được cải thiện; 2% bệnh nhân gặp phải các biến cố có hại do miễn dịch (imAE) độ 3/4 trong nhóm dùng durvalumab so với 1% trong nhóm dùng giả dược. Gần đây, nhiều nghiên cứu thực tế về sự kết hợp CisGem-durvalumab đã xác nhận kết quả của thử nghiệm này và tính an toàn của sự kết hợp này. Thử nghiệm giai đoạn 3 KEYNOTE-966 đã chứng minh lợi ích của pembrolizumab (kháng thể kháng PD-1) kết hợp với CisGem so với CisGem đơn độc trong bối cảnh này.6,7 Sự khác biệt chính trong thiết kế với TOPAZ-1 là khả năng duy trì gemcitabine sau 6 tháng dùng CisGem. KEYNOTE-966 cho thấy sự cải thiện đáng kể ở điểm cuối chính của OS (trung bình là 12,7 so với 10,9 tháng). Ngưỡng hiệu quả cho lợi ích PFS không đạt được theo thiết kế thống kê của thử nghiệm, có thể là do gemcitabine duy trì có thể cải thiện kết quả ở nhóm đối chứng. Các imAE cấp độ 3/4 được thấy ở 7% bệnh nhân trong nhóm pembrolizumab so với 4% ở nhóm giả dược.
Lưu ý, cả TOPAZ-1 và KEYNOTE-966 đều không thể xác định được nhóm bệnh nhân nào sẽ được hưởng lợi nhiều hơn khi bổ sung ICI, ngay cả khi dựa trên biểu hiện PD-L1. Nhìn chung, các nghiên cứu giai đoạn 3 này cho thấy lợi ích khiêm tốn ở OS, nhưng tỷ lệ OS 1, 2 và 3 năm chưa từng có với liệu pháp hóa miễn dịch là phương pháp điều trị đầu tay, mà không làm tăng độc tính quá mức. Do đó, các kết hợp này hiện là tiêu chuẩn chăm sóc và cả durvalumab và pembrolizumab đều được EMA chấp thuận kết hợp với CisGem làm phương pháp điều trị đầu tay cho BTC tiến triển. Tuy nhiên, trong khảo sát của chúng tôi, các bác sĩ từ sáu tổ chức khác nhau (n = 6 quốc gia, 16%) nhận xét rằng không có loại nào có sẵn tại trung tâm của họ (Hình 1).
Các tác nhân nhắm mục tiêu phân tử được EMA chấp thuận ở line thứ hai và hơn thế nữa
Các lựa chọn điều trị cho bệnh nhân mắc BTC tiến triển ngoài dòng đầu tiên bao gồm các liệu pháp nhắm mục tiêu phân tử và có thể tìm thấy các biến đổi có thể dùng thuốc ở 50% bệnh nhân mắc iCCA (Bảng 2).14,37 Tuy nhiên, tính khả dụng trong thực hành lâm sàng bị ảnh hưởng bởi nhiều yếu tố, bao gồm khả năng tiếp cận hồ sơ phân tử, phê duyệt thuốc và hoàn trả.
Sự hợp nhất/sắp xếp lại FGFR2 được tìm thấy ở 10–16% bệnh nhân mắc iCCA.37,57 Năm 2020, pemigatinib cho thấy hiệu quả ở những bệnh nhân đã được điều trị trước đó với sự hợp nhất/sắp xếp lại FGFR2, với ORR là 37%, DCR là 82,4%, PFS trung bình là 7 tháng và OS trung bình là 17,5 tháng.9,10 Những kết quả này cũng đã được xác nhận trong bối cảnh thực tế.58,59 Pemigatinib được chỉ định là “thuốc mồ côi” vào năm 2018 (EU/3/18/2066) và được EMA chấp thuận (ủy quyền có điều kiện) vào năm 2021. Gần đây hơn, futibatinib đã chứng minh hoạt động lâm sàng ở những bệnh nhân được điều trị trước đó với sự hợp nhất/sắp xếp lại FGFR2, mang lại ORR là 42% và DCR là 83%; PFS trung bình là 9 tháng và OS trung bình là 21,7 tháng. Dựa trên những kết quả này, EMA đã có điều kiện cho phép vào năm 2023. Các tác nhân nhắm mục tiêu FGFR bổ sung đã báo cáo lợi ích lâm sàng ở những bệnh nhân có CCA được điều trị trước có chứa hợp nhất/sắp xếp lại FGFR2: infigratinib, derazantinib, lirafugratinib, và tinengotinib. Cả infigratinib và derazantinib đều chưa được các cơ quan quản lý của Châu Âu chấp thuận, với việc infigratinib bị thu hồi giấy phép tiếp thị vào năm 2022. Lirafugratinib và tinengotinib được EMA chỉ định là thuốc đơn dòng cho BTC vào năm 2022 và 2024.
Tuy nhiên, vào năm 2023, có thông báo rằng chương trình lirafugratinib để điều trị cho bệnh nhân mắc BTC đã bị tạm dừng do tác động tài chính của Đạo luật giảm lạm phát. Đáng chú ý là số lượng tác nhân ngày càng tăng trong cùng một không gian quản lý có thể ảnh hưởng đến chiến lược tiếp thị của các công ty dược phẩm khác nhau. Xét đến hiệu quả của các chất ức chế FGFR, người ta đã nỗ lực đánh giá hiệu quả của chúng ở phác đồ đầu tiên, nhưng cả thử nghiệm FOENIX-CCA3 về futibatinib so với CisGem (NCT04093362) và thử nghiệm PROOF 301 về infigratinib so với CisGem (NCT03773302) đều đã bị ngừng do tích lũy chậm. Thử nghiệm giai đoạn 3 ngẫu nhiên FIGHT-302 nhằm mục đích đánh giá thêm hiệu quả và độ an toàn của pemigatinib trong phác đồ đầu tiên, nhưng ngay cả trong trường hợp này, việc tích lũy bệnh nhân có thể là một hạn chế.63
Đột biến IDH1 được tìm thấy ở 10–15% bệnh nhân mắc iCCA. Năm 2020, trong thử nghiệm giai đoạn 3 ClarIDHy—thử nghiệm giai đoạn 3 hoàn thành duy nhất cho đến nay đánh giá tác nhân nhắm mục tiêu phân tử trong BTC—ivosidenib đã chứng minh lợi ích lâm sàng ở những bệnh nhân mắc CCA đột biến IDH1 những người đã được điều trị tới hai lần trước đó cho bệnh tiến triển (OS trung bình 10,3 tháng, PFS trung bình 2,7 tháng). Kết quả tương tự đã được quan sát thấy trong loạt nghiên cứu thực tế. Ivosidenib đã được chỉ định là thuốc mồ côi vào năm 2018 (EU/3/18/1994) và được EMA chấp thuận vào năm 2023 cho những bệnh nhân có đột biến CCA và IDH1 R132 đã được điều trị trước.
HER2 được khuếch đại hoặc biểu hiện quá mức ở 20% bệnh nhân mắc eCCA và 5% bệnh nhân mắc iCCA, trong khi đột biến hiếm gặp hơn. Một thử nghiệm đơn nhánh giai đoạn 2 của trastuzumab/FOLFOX dòng thứ hai đã mang lại PFS trung bình là 5,1 tháng, ORR là 29,4% và OS là 10,7 tháng ở những bệnh nhân có BTC dương tính với HER2. Các tác nhân đầy hứa hẹn khác nhắm vào HER2 cho những bệnh nhân mắc BTC đã được điều trị trước bao gồm pertuzumab/trastuzumab (ORR 23%), zanidatamab (ORR 41,3%), trastuzumab deruxtecan (ORR 37,1%), và tucatinib/trastuzumab (ORR 46,7%). Zanidatamab đã được EMA chỉ định là thuốc đơn độc (EU/3/21/2458) và được (FDA US) chấp thuận để điều trị BTC. Vào năm 2024, FDA đã cấp phép tăng tốc không phân biệt khối u cho trastuzumab deruxtecan để điều trị cho những bệnh nhân có khối u rắn dương tính với HER2 tiến triển đã được điều trị trước đó (miễn dịch mô hóa học [IHC] 3+) mà không có các lựa chọn điều trị thay thế. Ngược lại, nó đã nhận được sự cho phép tiếp thị có điều kiện của EMA (với sự giám sát bổ sung) chỉ để điều trị cho những bệnh nhân có các loại khối u dương tính với HER2 đã chọn, không bao gồm BTC.
Đột biến BRAF được tìm thấy ở 9% bệnh nhân mắc BTC, với đột biến BRAF loại I xảy ra ở khoảng 3%.Trong thử nghiệm giỏ hàng Nghiên cứu Ung thư hiếm giai đoạn 2, một nhánh, dabrafenib (chất ức chế BRAF) cộng với trametinib (chất ức chế MEK) cho thấy hoạt động đầy hứa hẹn (ORR được đánh giá bởi người đánh giá độc lập là 47%) và hồ sơ an toàn có thể kiểm soát được ở những bệnh nhân mắc BTC được điều trị trước có đột biến BRAF V600E.50 Dabrafenib/trametinib đã nhận được sự chấp thuận không phụ thuộc vào khối u từ FDA. Giấy phép tiếp thị của EMA áp dụng cho ung thư hắc tố tiến triển có đột biến BRAF V600, ung thư phổi không phải tế bào nhỏ (NSCLC), u thần kinh đệm cấp độ thấp và BTC ở một số quốc gia được chọn. Ví dụ, từ tháng 7 năm 2024, dabrafenib/trametinib có sẵn tại Ý cho những bệnh nhân đã được điều trị trước đó với BTC tiến triển có đột biến BRAF V600E trong một chương trình sử dụng từ thiện công cộng toàn quốc (“Legge 648”). Dữ liệu gần đây hơn hỗ trợ hoạt động của cobimetinib cộng với vemurafenib theo cách không xác định, cho thấy ORR đầy hứa hẹn (57%) ở các khối u rắn (n = 31) có đột biến BRAF V600E; tuy nhiên, hiện tại, giấy phép tiếp thị của EMA chỉ có sẵn cho bệnh u hắc tố.
Pembrolizumab ban đầu cho thấy lợi ích lâm sàng ở những bệnh nhân mắc bệnh ung thư không phải trực tràng thiếu sửa chữa không khớp (dMMR), bao gồm bốn bệnh nhân mắc bệnh ung thư CCA hoặc ung thư bóng Vater (ORR 71%). Dữ liệu này đã được xác nhận trong thử nghiệm KEYNOTE-158 (22 bệnh nhân mắc CCA đã được điều trị trước [ORR 40,9%]). Do đó, từ năm 2022, thuốc đã nhận được giấy phép tiếp thị của EMA cho những bệnh nhân mắc khối u tiến triển MSI-H hoặc dMMR đã được điều trị trước, bao gồm BTC. Thông thường, gánh nặng đột biến khối u (≥10 đột biến/megabase) cũng được sử dụng để hướng dẫn tiếp cận ICI, nhưng nó không chứng minh được giá trị dự đoán ở những bệnh nhân mắc BTC.
Sự hợp nhất gen NTRK và RET rất hiếm ở BTC (mỗi loại dưới 1%). Larotrectinib và entrectinib (thuốc chống NTRK) có giấy phép tiếp thị có điều kiện của EMA ở những bệnh nhân có khối u rắn chứa sự hợp nhất gen NTRK, trong khi selpercatinib (thuốc chống RET) có giấy phép tiếp thị có điều kiện của EMA đối với những bệnh nhân đã được điều trị trước đó có sự hợp nhất gen RET và không có lựa chọn điều trị nào khác.
Đột biến KRASG12C có trong 1,1% BTC và có thể được nhắm mục tiêu bởi các chất ức chế KRAS đã chọn. Sotorasib đã được cấp phép tiếp thị cho NSCLC; cuối cùng, adagrasib chỉ được EMA cấp phép tiếp thị có điều kiện cho những bệnh nhân mắc NSCLC đột biến KRASG12C tiến triển, bất chấp dữ liệu về hiệu quả của nó.56 Trong giai đoạn 2010–2019, trong số 89 liệu pháp điều trị ung thư mới, FDA đã chấp thuận 95% trước khi được châu Âu cấp phép.74 Ngoài ra, thời gian trung bình (IQR) để FDA xem xét là 200 ngày (155–277) so với 426 ngày (358–480) của EMA, vượt quá dự đoán khoảng một năm đối với những bệnh nhân mắc BTC tiến triển.3–8 Các chương trình tiếp cận sớm có thể là một giải pháp giúp tiếp cận sớm hơn với các loại thuốc đang được nghiên cứu ở châu Âu.75 Các nhà sản xuất thuốc nộp các tài liệu quản lý cho FDA sớm hơn so với EMA, có thể là do thị phần lớn hơn và chi phí thuốc cao hơn ở Hoa Kỳ.
Mặc dù việc tiếp cận các loại thuốc điều trị các bệnh hiếm gặp như BTC phải là ưu tiên hàng đầu, nhưng điều kiện tiên quyết đối với các thử nghiệm lâm sàng được thiết kế tốt (ví dụ, thử nghiệm giỏ, sử dụng đối chứng tổng hợp) để cung cấp bằng chứng về tính an toàn và hiệu quả với mức giá bền vững phải chăng là tối quan trọng. Cho đến nay, tất cả các loại thuốc mục tiêu hiện có cho BTC đều đã được thử nghiệm trong các nghiên cứu một nhóm hoặc trong các thử nghiệm giỏ, ngoại trừ ivosidenib, trong đó nhóm đối chứng là giả dược.
Vào năm 2021, thử nghiệm ABC-06 đã xác định mFOLFOX là tiêu chuẩn chăm sóc ở tuyến hai và đặt ra chuẩn mực cho OS là 6,2 tháng. Vì tất cả các thử nghiệm này đều có trước nghiên cứu ABC-06, không có nghiên cứu quản lý nào đối với các liệu pháp mục tiêu bao gồm mFOLFOX là thuốc so sánh phù hợp. Mặc dù việc thiếu so sánh trực tiếp khiến việc giải thích kết quả trở nên khó khăn hơn, nhưng hoạt động đáng chú ý về lợi ích lâm sàng, cũng được phản ánh trong OS trung bình kéo dài (dao động từ 10,3 đến 21,7 tháng với các liệu pháp mục tiêu), đã là cơ sở cho các phê duyệt.
Thách thức bổ sung về thời gian hoàn trả cho các loại thuốc này cũng cần được thừa nhận. Thời hạn hoàn trả cho các loại thuốc chống ung thư mới trong giai đoạn 2016–2021 (180 ngày), theo khuyến nghị của Hội đồng cộng đồng châu Âu theo chỉ thị Tiếp cận thị trường của Liên minh châu Âu, đã được Đức đáp ứng đối với 100% các loại thuốc được đưa vào, Pháp đáp ứng 51%, Vương quốc Anh (UK) và Hà Lan đáp ứng 29%, Thụy Sĩ đáp ứng 14%, Na Uy đáp ứng 6% và Bỉ đáp ứng 3%. Người ta báo cáo rằng các yếu tố liên quan đến thời gian hoàn trả ngắn hơn bao gồm tổng sản phẩm quốc nội (GDP) cao hơn, không có thủ tục đánh giá trước và do một công ty dược phẩm lớn nộp hồ sơ. Trong nghiên cứu này, có sự bất bình đẳng trong việc tiếp cận các loại thuốc này giữa bảy quốc gia có thu nhập cao này, có thể chỉ là một phần nhỏ so với sự bất bình đẳng giữa các quốc gia này và các quốc gia châu Âu có GDP thấp hơn. Hơn nữa, theo khảo sát của chúng tôi, bệnh nhân chỉ được tiếp cận với tất cả các tác nhân nhắm mục tiêu đã được EMA chấp thuận tại một phần ba số cơ sở (Hình 1). Việc trì hoãn phê duyệt durvalumab, pembrolizumab, pemigatinib, futibatinib và ivosidenib ở nhiều nước châu Âu, mặc dù đã được EMA cho phép, là một ví dụ điển hình về sự khác biệt trong khả năng tiếp cận các liệu pháp chống ung thư trên khắp châu Âu (Hình 2).
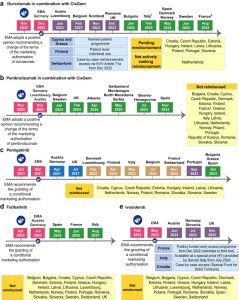
Hình 2 Dòng thời gian phê duyệt durvalumab (a) và pembrolizumab (b) kết hợp với hóa trị liệu, pemigatinib (c), futibatinib (d) và ivosidenib (e) để điều trị ung thư đường mật ở Châu Âu. 1 Từ ngày 21 tháng 3 năm 2022 đến ngày 18 tháng 2 năm 2024, durvalumab kết hợp với hóa trị liệu đã có sẵn tại Ý thông qua chương trình bệnh nhân được chỉ định do AstraZeneca Ý cung cấp. 2 Từ tháng 10 năm 2022 đến ngày 31 tháng 7 năm 2024, durvalumab kết hợp với hóa trị liệu đã có sẵn tại Pháp thông qua chương trình tiếp cận sớm được tài trợ công khai trong nhóm dân số ITT. 3 Tại Pháp, việc tiếp cận sớm pembrolizumab kết hợp với hóa trị liệu do công chúng tài trợ đã bị từ chối vào ngày 21 tháng 3 năm 2023. Vào năm 2020 và 2021, pemigatinib đã có sẵn tại Pháp thông qua chương trình tiếp cận sớm được tài trợ công khai (ATU). Chữ viết tắt: ATU, giấy phép sử dụng tạm thời; CisGem, cisplatin và gemcitabine; EMA, Cơ quan Dược phẩm Châu Âu; ITT, ý định điều trị; KVV, Verordnung über die Krankenversicherung (Pháp lệnh Bảo hiểm Y tế); Anh, Vương quốc Anh.
Hướng dẫn của Châu Âu về lập hồ sơ phân tử
Lập hồ sơ phân tử là điều cần thiết để cung cấp thông tin về các lựa chọn điều trị cho bệnh nhân mắc BTC tiến triển đang được cân nhắc để điều trị toàn thân và nên được thực hiện sớm nhất có thể. Nhiều kinh nghiệm trong các thử nghiệm không phân biệt khối u đã cung cấp bằng chứng về lợi ích lâm sàng của phương pháp tiếp cận ung thư chính xác dựa trên lập hồ sơ bộ gen so với chiến lược chung, như đã được chứng minh trong các thử nghiệm MOSCATO-01 và I-PREDICT. Mặc dù số lượng bệnh nhân mắc BTC là nhỏ trong cả hai nghiên cứu, nhưng không có lý do gì để tin rằng kết quả không thể áp dụng cho nhóm dân số phụ này. Thử nghiệm SAFIR ABC-10 đang diễn ra (NCT05615818), so sánh liệu pháp nhắm mục tiêu là phương pháp điều trị duy trì sau bốn chu kỳ hóa trị liệu tiêu chuẩn so với việc tiếp tục điều trị tiêu chuẩn ở những bệnh nhân có biến đổi có thể dùng thuốc, sẽ cung cấp câu trả lời chắc chắn về BTC.
Nhóm công tác y học chính xác của Hiệp hội ung thư y khoa châu Âu (ESMO) đã khuyến nghị giải trình tự khối u thế hệ tiếp theo (NGS) cho CCA vào năm 2020, được tái xác nhận trong bản cập nhật năm 2024 của họ. Tương tự như vậy, Hướng dẫn thực hành lâm sàng về ung thư đường mật của ESMO khuyến nghị mạnh mẽ việc lập hồ sơ phân tử cho những bệnh nhân mắc bệnh tiến triển.
Giải trình tự song song nhiều gen bằng NGS tập trung được ưu tiên hơn so với xét nghiệm gen đơn lẻ. Đây là phương pháp hiệu quả nhất để phát hiện các biến đổi di truyền có tỷ lệ mắc bệnh riêng lẻ thấp từ 1–10%, nhưng tổng cộng khoảng 30–40% đối với eCCA và 40–50% đối với iCCA.
NGS có thể được thực hiện trên mô khối u cố định bằng formalin và nhúng trong parafin. Ngoài ra, có thể cân nhắc sinh thiết lỏng sử dụng DNA lưu thông không có tế bào, nếu không có đủ mô khối u cho NGS, mặc dù việc thiếu dữ liệu về việc cắt nhỏ DNA của BTC là một hạn chế. Tuy nhiên, sinh thiết lỏng sẽ tiếp tục là một công cụ hữu ích để xác định các biến đổi phân tử khi không có mô và theo dõi phản ứng với liệu pháp nhắm mục tiêu theo chiều dọc. Tuy nhiên, tính hữu ích của phân tích khối u tuần hoàn (ctDNA) sẽ bị giới hạn ở một tập hợp các biến đổi phân tử cụ thể.
Trong một nhóm đối tượng triển vọng lớn với hơn 1000 bệnh nhân, tiện ích của ctDNA đã được chứng minh với tỷ lệ phù hợp giữa mô và huyết tương >85% trong các đột biến liên quan đến BTC như IDH1 và BRAF V600E, một kết quả cũng đã được xác nhận trong các nhóm đối tượng khác. Tuy nhiên, những dữ liệu này không thể dịch sang hợp nhất FGFR2, trong đó tỷ lệ phù hợp chỉ là 18%. Các công nghệ gần đây hơn, như bảng Illumina được sử dụng trong thử nghiệm FOENIX-CCA2, đã chứng minh tỷ lệ phù hợp tốt hơn giữa mô và huyết tương (≥80%), nhưng chúng cần được xác nhận trong các nhóm đối tượng khác.
Hiện tại, bảng gen phải bao gồm tối thiểu các vùng DNA mã hóa của IDH1, HER2 và BRAF để xét nghiệm các đột biến điểm nóng. Tuy nhiên, bối cảnh phát triển nhanh chóng của các mục tiêu thuốc và các dấu ấn sinh học dự đoán có thể sớm đòi hỏi các bảng lớn hơn và các phân tích bổ sung như được trình bày chi tiết trong đoạn tiếp theo. Đối với xét nghiệm dựa trên mô, các hợp nhất gen liên quan đến các gen FGFR2, RET và NTRK nên được thẩm vấn ở cấp độ RNA bằng phương pháp dựa trên bảng có thể xác định bản sao hợp nhất của các đối tác hợp nhất đã biết và chưa biết.16 Sự khuếch đại HER2 nên được thử nghiệm bằng IHC, tìm kiếm biểu hiện 3+ như một dấu ấn sinh học phản ứng với các liệu pháp chống HER2.
Trạng thái MSI có thể được suy ra thông qua xét nghiệm IHC đánh giá biểu hiện mô khối u của MLH1, MSH2, MSH6 và PMS2. Ngoài ra, có thể sử dụng các xét nghiệm dựa trên DNA phân tích thành phần và chiều dài của vi vệ tinh.16 Sự kết hợp của hai kỹ thuật này có thể làm giảm tỷ lệ dương tính giả với khả năng xác định tốt hơn những người đáp ứng tốt với liệu pháp miễn dịch.
Công nghệ được ưu tiên phụ thuộc vào mục tiêu và tính khả dụng của vật liệu để thử nghiệm [ví dụ: mô hoặc ctDNA]. Khuyến cáo mạnh mẽ nên tham khảo ý kiến của bác sĩ bệnh học phân tử hoặc hội đồng khối u phân tử.
Tính khả dụng và khả năng tiếp cận của hồ sơ phân tử và liệu pháp mới tại Châu Âu
Một số yếu tố đã cản trở việc đưa công nghệ NGS vào thực hành thường quy trên khắp Châu Âu: (i) khả năng tiếp cận công nghệ NGS cao hơn ở các quốc gia có hệ thống hoàn trả quốc gia công cộng; (ii) Các quốc gia Trung và Đông Âu thiếu cơ sở hạ tầng xét nghiệm, triển khai kỹ thuật và chương trình đào tạo theo kế hoạch cho nhân viên phòng xét nghiệm; (iii) hơn hai phần ba các quốc gia không có sáng kiến quốc gia về xét nghiệm bộ gen; (iv) hệ thống xét nghiệm kiểm soát chất lượng thường bị thiếu và ở nhiều quốc gia, các phòng xét nghiệm đang sử dụng các bảng tùy chỉnh; (v) ở một số quốc gia châu Âu, bệnh nhân phải trả toàn bộ hoặc một phần chi phí xét nghiệm dấu ấn sinh học, hạn chế khả năng tiếp cận các lựa chọn chẩn đoán và điều trị đối với những cá nhân giàu có. Do đó, việc phân phối và ứng dụng xét nghiệm NGS không nhất quán và rất không đồng nhất giữa các quốc gia khác nhau, với việc ứng dụng NGS cao nhất ở Tây Âu và Bắc Âu, trong khi ở một số quốc gia, tính khả dụng vẫn chỉ giới hạn ở các thử nghiệm lâm sàng hoặc nghiên cứu cơ bản. Theo khảo sát của chúng tôi, trong 25% trường hợp, bác sĩ giới thiệu đến một tổ chức khác để lập hồ sơ bộ gen. Ngoài ra, tại sáu tổ chức (17%), giải trình tự phân tử thậm chí không thể tiếp cận được thông qua hệ thống chăm sóc sức khỏe quốc gia, với bốn tổ chức trong số đó giới hạn việc sử dụng cho các hoạt động hành nghề tư nhân hoặc nghiên cứu (Hình 1).
Một thách thức quan trọng khác là sự không phù hợp giữa việc phê duyệt thuốc của các cơ quan quốc tế và việc cấp phép và hoàn trả giá xét nghiệm dấu ấn sinh học phù hợp ở cấp quốc gia. Một số quốc gia đã cố gắng giải quyết vấn đề này. Tại Bỉ, cái gọi là Nền tảng CDx bao gồm các năng lực của “Ủy ban hoàn trả thuốc” và “Hội đồng y khoa kỹ thuật”; nó đã được phát triển để cho phép thực hành xét nghiệm dấu ấn sinh học đầy đủ và bền vững trong hệ thống chăm sóc sức khỏe quốc gia.
Tại Ý, hai sáng kiến riêng biệt của Bộ Y tế về việc triển khai các công nghệ NGS để mô tả đặc điểm phân tử của các dấu ấn sinh học dự đoán cho NSCLC và CCA di căn/tiến triển tại chỗ hỗ trợ xét nghiệm trên cơ sở khu vực.90 Tại Tây Ban Nha, các mẫu BTC có thể được chuyển đến để xét nghiệm NGS quốc gia khi không có xét nghiệm tại địa phương, như một phần của sáng kiến “Xác định các dấu ấn phân tử ở những bệnh nhân có trong Sổ đăng ký khối u tiêu hóa của Tây Ban Nha (RETUD) TTD-20-01”.
Việc tiếp cận các liệu pháp nhắm mục tiêu mới cũng có thể bị ảnh hưởng tương tự ở cấp quốc gia/siêu quốc gia do các quyết định đánh giá thuốc khác nhau do FDA và EMA đưa ra. EMA thường được đặc trưng bởi sự chấp thuận bị hoãn lại so với FDA. Ví dụ, việc phê duyệt ba hợp chất chống FGFR2 hiện có diễn ra như sau: pemigatinib được FDA và EMA chấp thuận vào năm 2020 và 2021; infigratinib được FDA chấp thuận vào năm 2021, FDA rút lại vào năm 2022; và futibatinib được FDA chấp thuận vào năm 2022, EMA chấp thuận vào năm 2023.
Như đã đề cập, không có mối liên hệ trực tiếp nào giữa sự chấp thuận của các cơ quan quản lý và việc hoàn trả ở cấp độ quốc gia đơn lẻ.93 Ngoại lệ duy nhất ở Châu Âu là Đức, nơi sự chấp thuận ngụ ý việc hoàn trả gần như ngay lập tức. Theo báo cáo của Liên đoàn các ngành công nghiệp và hiệp hội dược phẩm Châu Âu, thời gian trung bình để hoàn trả cho các phương pháp điều trị tiên tiến là 511 ngày, dao động từ 133 ngày ở Đức đến hơn 899 ngày ở Romania.94 Điều này một phần là do thực tế là các tiêu chí được sử dụng để hoàn trả thuốc ở cấp độ quốc gia đơn lẻ có thể khác với các tiêu chí được các cơ quan quản lý siêu quốc gia sử dụng. Ví dụ, ở Hà Lan, các tiêu chí PASKWIL được áp dụng để xác định lợi ích sức khỏe do các loại thuốc mới mang lại và dựa trên lợi thế tối thiểu về OS và PFS, điều này có thể ảnh hưởng đến việc cấp phép tiếp thị cho nhiều loại thuốc BTC. Ngoài ra, dữ liệu về kết quả lâm sàng cần được đưa vào đánh giá rộng hơn để xác định cụ thể hiệu quả về chi phí của một loại thuốc mới trong một nhóm dân số nhất định. Điều này sẽ bị ảnh hưởng bởi dịch tễ học của bệnh ở quốc gia đó, khả năng tiếp cận xét nghiệm chẩn đoán phù hợp, chi phí quản lý tác dụng phụ và các biến chứng liên quan đến tiến triển của bệnh.
Điều này ngụ ý rằng tính khả dụng của thuốc thay đổi đáng kể giữa các quốc gia châu Âu khác nhau và nhấn mạnh nhu cầu cộng đồng châu Âu nỗ lực đảm bảo tiếp cận có đạo đức và bình đẳng với các liệu pháp mới và xét nghiệm sinh học dự đoán liên quan, đồng thời tập trung vào việc tìm ra các giải pháp tiết kiệm chi phí để điều trị cho bệnh nhân mắc BTC tiến triển.
Thách thức trong việc tiếp cận xét nghiệm và lập hồ sơ
Việc tiếp cận lập hồ sơ khối u trong BTC đặt ra một số thách thức, có thể được phân loại thành các rào cản về mặt kỹ thuật, kinh tế hoặc hệ thống.
Các rào cản kỹ thuật liên quan đến các đặc điểm nội tại của BTC. Do vị trí giải phẫu của nó, việc thu thập đủ mô chất lượng cao để phân tích phân tử có thể là một thách thức. CCA quanh rốn và xa thường chỉ được chẩn đoán bằng cách chải, với năng suất mẫu tế bào thấp, đặc biệt là ở giai đoạn tiến triển tại chỗ khi không có tổn thương di căn có thể nhắm mục tiêu khác.96 Các nhà nghiên cứu bệnh học được yêu cầu xử lý các mẫu mô cẩn thận để xác nhận chẩn đoán trong khi đảm bảo bảo tồn mô để lập hồ sơ phân tử mà không làm cạn kiệt mẫu. Ngay cả khi lấy được sinh thiết kim nhỏ, DNA/RNA chất lượng kém hoặc không đủ có thể làm giảm độ chính xác của lập hồ sơ bộ gen, do số lượng tế bào thấp và mô đệm phong phú của BTC.98 Tính không đồng nhất của khối u làm phức tạp vấn đề này, vì một sinh thiết duy nhất có thể không đại diện cho toàn bộ bối cảnh bộ gen của khối u, điều này có thể dẫn đến hồ sơ phân tử không đầy đủ hoặc không chính xác. Ngoài ra, mô đệm và môi trường vi mô của khối u có thể đóng vai trò trong phản ứng thuốc, hiện vẫn chưa được hiểu đầy đủ và có thể không được NGS nắm bắt. Hơn nữa, kiến trúc bộ gen của BTC có thể phát triển theo thời gian và để đáp ứng với các phương pháp điều trị, đòi hỏi phải lập hồ sơ nhiều lần, điều này có thể khó thực hiện trong thực hành lâm sàng. Sinh thiết lỏng có thể khắc phục một số hạn chế này, nhưng độ nhạy có thể bị hạn chế đối với BTC không rụng và phát hiện các hợp nhất, khuếch đại và xóa đoạn lớn.
Theo quan điểm kinh tế, chi phí lập hồ sơ bộ gen toàn diện có thể cao đến mức không thể chấp nhận được, hiện tại chỉ giới hạn việc sử dụng ở các trung tâm có đủ nguồn lực tài chính cần thiết. Hơn nữa, phạm vi bảo hiểm cho việc lập hồ sơ bộ gen không nhất quán giữa các quốc gia khác nhau hoặc trong các hệ thống chăm sóc sức khỏe, thường đòi hỏi phải có lý do chính đáng về tiện ích lâm sàng của nó để đảm bảo được phạm vi bảo hiểm.81 Tuy nhiên, điều quan trọng là phải nhấn mạnh tính liên quan của việc lập hồ sơ bộ gen trong việc hướng dẫn các quyết định điều trị trong BTC và sự cần thiết phải phân phối lại các nguồn lực một cách hiệu quả để đảm bảo ứng dụng rộng rãi của nó.
Các rào cản hệ thống bao gồm nhiều vấn đề, bao gồm các rào cản về mặt quy định có thể làm chậm trễ việc phê duyệt các xét nghiệm và liệu pháp phân tử mới. Ngoài ra còn có sự khác biệt trong các tiêu chuẩn và thông lệ về lập hồ sơ bộ gen, điều này có thể dẫn đến sự không nhất quán về tính khả dụng và chất lượng của xét nghiệm.101 Hơn nữa, tốc độ phát triển nhanh chóng của lĩnh vực bộ gen ung thư đòi hỏi các khuôn khổ quản lý phải theo kịp các diễn biến mới, để tránh sự chậm trễ trong việc triển khai các thông lệ. Ngoài ra, cần phải vận động cho sự công bằng trong việc tiếp cận xét nghiệm thông qua khả năng chi trả cao hơn và mở rộng phạm vi bảo hiểm, đồng thời giáo dục các bác sĩ lâm sàng về cách giải thích và ứng dụng dữ liệu bộ gen. Việc giải quyết các rào cản này sẽ rất quan trọng để tận dụng tối đa tiềm năng của y học chính xác trong việc cải thiện kết quả cho bệnh nhân mắc BTC.
Kháng thuốc nhắm đích
Mặc dù có những tiến bộ gần đây trong liệu pháp nhắm đích cho BTC tiến triển, nhưng tình trạng kháng thuốc mắc phải và nội tại đối với liệu pháp nhắm đích vẫn là một hạn chế đáng kể.
Tình trạng kháng thuốc ức chế FGFR nguyên phát dường như có liên quan đến các biến đổi phân tử đồng thời xảy ra, chẳng hạn như TP53 và CDKN2A, mặc dù bằng chứng vẫn chưa đủ mạnh để cung cấp thông tin cho thực hành lâm sàng. Trong số những bệnh nhân có sự hợp nhất gen CCA và FGFR2 được điều trị bằng chất ức chế FGFR chọn lọc, đột biến miền kinase FGFR2 thứ cấp được phát hiện ở 60% trường hợp, từ ctDNA sau tiến triển hoặc sinh thiết mô. Những đột biến này thường được tìm thấy ở phần dư gatekeeper, kiểm soát khả năng tiếp cận túi liên kết hoặc ở phần dư break phân tử, tạo thành mạng lưới liên kết hydro để giảm hoạt hóa kinase.103 Hiếm khi, đột biến mắc phải ảnh hưởng đến vị trí liên kết cộng hóa trị của chất ức chế không thể đảo ngược futibatinib đã được báo cáo. Trong trường hợp không có đột biến thứ cấp ở FGFR2, hoạt hóa các con đường hạ lưu của FGFR2, bao gồm PIK3CA, Ras và Raf, có thể góp phần gây ra tình trạng kháng thuốc chính hoặc thứ cấp, do đột biến hoạt hóa mắc phải hoặc do chọn lọc quần thể bán nhân bản đã tồn tại từ trước. Các chất ức chế FGFR2 có tính chọn lọc cao đã chứng minh khả năng khắc phục các cơ chế kháng thuốc tại mục tiêu này trong ống nghiệm và trong cơ thể sống, và các nghiên cứu triển vọng đang được tiến hành ở những bệnh nhân tiến triển khi điều trị bằng liệu pháp nhắm mục tiêu FGFR2. Một ví dụ là tinengotinib, thuốc nhắm vào vị trí liên kết FGFR2 cách xa túi bên trong để tránh tác động của các đột biến tuần tự.
Cơ chế kháng thuốc chính và thứ cấp đối với liệu pháp ức chế IDH1 ở CCA đột biến IDH1 ít được biết đến hơn. Ở một số ít bệnh nhân, các đột biến tăng chức năng thứ cấp ở IDH2 đã được phát hiện sau quá trình điều trị kéo dài bằng ivosidenib, nhưng ý nghĩa sinh học và lâm sàng của chúng vẫn chưa rõ ràng. Các đột biến mắc phải ở IDH1 cũng đã được mô tả, dẫn đến suy giảm khả năng liên kết với ivosidenib và tiếp tục sản xuất 2-hydroxyglutarate. Các chất ức chế không hồi phục của IDH1 đột biến, dùng riêng lẻ hoặc kết hợp với hóa trị liệu, đã cho thấy hiệu quả đầy hứa hẹn trong các nghiên cứu tiền lâm sàng và lâm sàng giai đoạn đầu trong việc khắc phục các cơ chế kháng thuốc tại mục tiêu này.
Phân tích trình tự ctDNA trong quá trình điều trị bằng liệu pháp nhắm mục tiêu giúp mô tả theo chiều dọc quá trình tiến triển của khối u và phản ánh cơ chế đa dòng của tình trạng kháng thuốc mắc phải tốt hơn so với phân tích một mẫu sinh thiết đơn lẻ.108 Việc tiếp cận rộng rãi hơn với sinh thiết lỏng có thể cho phép phát hiện sớm hơn các đột biến kháng thuốc thứ cấp, cho phép đưa vào sử dụng các loại thuốc mới có thể kéo dài lợi ích lâm sàng và tối ưu hóa trình tự của các loại thuốc nhắm mục tiêu khác nhau hiện có. Ví dụ, ở những bệnh nhân có sự hợp nhất/sắp xếp lại FGFR2, sẽ có lợi khi xác định sớm hơn thời điểm khởi phát các đột biến kháng thuốc thứ cấp do có sự hiện diện của các loại thuốc mới có tác dụng trên các dòng kháng thuốc ức chế FGFR2 thế hệ đầu tiên.
Tuy nhiên, việc tiếp cận phân tích ctDNA chất lượng cao và các thử nghiệm lâm sàng về thuốc ức chế thế hệ thứ hai khác nhau giữa các quốc gia và nhóm kinh tế xã hội và là rào cản lớn đối với việc cải thiện kết quả điều trị.
Liệu pháp tại chỗ
Có tới 50% bệnh nhân mắc BTC tiến triển có bệnh tiến triển tại chỗ. Trong nhóm bệnh nhân này, việc kiểm soát bệnh tại chỗ có thể được cải thiện bằng cách kết hợp điều trị tại chỗ (LRT) và liệu pháp toàn thân,109 một mục tiêu có tầm quan trọng tối cao khi xét đến việc hầu hết bệnh nhân (70%) mắc iCCA tử vong do tiến triển bệnh trong gan chứ không phải do bệnh ngoài gan.110 Điểm chuẩn cho LRT ở iCCA đã được thiết lập bằng phân tích nhóm của các thử nghiệm ABC cho thấy OS 3 năm là 3% đối với hóa trị liệu toàn thân.
Thử nghiệm Misphec một nhánh đã nghiên cứu việc bổ sung Xạ trị nội chọn lọc (SIRT) hàng đầu vào CisGem.112 Trong một so sánh điểm khuynh hướng phù hợp với một số thử nghiệm lâm sàng chỉ nghiên cứu điều trị toàn thân, OS cao hơn ở những bệnh nhân cũng được điều trị bằng SIRT (HR 0,59; 95% CI, 0,34–0,99, p = 0,049).
Bốn thử nghiệm giai đoạn 2 một nhánh đã nghiên cứu lợi ích của hóa trị liệu bằng bơm truyền động mạch gan với floxuridine.114–117 Cơ sở lý luận là floxuridine (một chất tương tự 5-FU) có tác dụng vượt qua lần đầu 95% ở gan với mức phơi nhiễm cao hơn 200 lần ở các tế bào ung thư so với dùng toàn thân. Bốn thử nghiệm đã tìm thấy ORR dao động từ 38% đến 58% với OS 3 năm là 29%–43%. Một thử nghiệm ngẫu nhiên có triển vọng có thể cung cấp dữ liệu xác định hơn để thông báo cho thực hành lâm sàng.
Cuối cùng, liệu pháp xạ trị định vị thân (SBRT) đã được nghiên cứu kết hợp với CisGem trong thử nghiệm ABC-07 ngẫu nhiên, bao gồm 69 bệnh nhân bị CCA tiến triển tại chỗ. Không tìm thấy sự khác biệt nào về OS (HR 1.0; 95% CI, 0,5–1,5, p = 0,63). Tuy nhiên, một số bệnh nhân được chọn có thể được hưởng lợi từ SBRT trong trường hợp không tiến triển đến điều trị toàn thân khởi đầu; sẽ cần nhiều dữ liệu hơn để hiểu liệu các dấu ấn sinh học lưu hành (tức là ctDNA) có thể cung cấp thông tin chi tiết hữu ích trong bối cảnh này hay không.
Việc tiếp cận LRT khác nhau ở khắp Châu Âu. Các thử nghiệm không ngẫu nhiên đối với LRT cho thấy sự gia tăng đáng kể >5 lần về OS trong 3 năm ở những bệnh nhân mắc iCCA.114,117 Các thử nghiệm có đối chứng ngẫu nhiên (ví dụ: NCT02807181) có thể giúp đưa ra thông tin để bổ sung LRT vào các hướng dẫn CCA và đảm bảo khả năng tiếp cận phổ quát, nhưng việc tích lũy có thể gặp khó khăn do tiêu chí lựa chọn nghiêm ngặt và tính không đồng nhất trong tiên lượng của bệnh nhân. Trong khi đó, những bệnh nhân mắc BTC tại chỗ nên được thảo luận trong một cuộc họp đa ngành để xem xét LRT trước và sau khi điều trị toàn thân. Theo các cuộc khảo sát của chúng tôi, LRT, chẳng hạn như cắt đốt bằng sóng cao tần, hóa chất tắc mạch xuyên động mạch và SBRT, vẫn chỉ được xem xét cho những bệnh nhân được chọn (Hình 1). Cần lưu ý rằng LRT thường tuân theo các lộ trình phê duyệt khác nhau vì cần phải xem xét tính an toàn và hiệu suất của các thiết bị được sử dụng.
Bàn luận
Việc quản lý BTC đã chứng kiến sự chuyển đổi đáng kể trong thập kỷ qua, với việc đưa hơn mười phương pháp điều trị mới vào các khuyến nghị quốc tế. Tuy nhiên, việc áp dụng chúng trong thực hành lâm sàng vẫn còn rất khác nhau trên khắp Châu Âu.
Thật thú vị khi lưu ý rằng một số biện pháp can thiệp được đưa vào nhanh hơn những biện pháp khác. Ví dụ, durvalumab đã nhận được sự chấp thuận theo quy định đầu tiên từ FDA vào tháng 9 năm 2022, sau đó là EMA vào tháng 12 năm 2022 và đã có mặt tại 17 quốc gia ở Châu Âu sau chưa đầy hai năm. Ngược lại, pemigatinib đã nhận được sự chấp thuận của FDA vào tháng 4 năm 2020, sự chấp thuận của EMA vào tháng 3 năm 2021 và vẫn chưa được phổ biến rộng rãi sau hơn ba năm. Những sự khác biệt này có thể liên quan đến một số yếu tố, từ số lượng bệnh nhân dự kiến sẽ được hưởng lợi, chi phí liên quan đến các liệu pháp mới, con đường quản lý của các cơ quan khu vực, mà còn liên quan đến cách tiếp cận đa dạng đối với các phê duyệt theo quy định của các ngành khác nhau và sự có/không có chẩn đoán đi kèm liên quan đến việc giới thiệu một liệu pháp mới. Điều đáng chú ý là ở một số quốc gia, việc phê duyệt thuốc và chẩn đoán đi kèm diễn ra song song (ví dụ: Đức), trong khi ở những quốc gia khác, chúng độc lập (ví dụ: Scotland), khiến thuốc có sẵn mà không cần chẩn đoán.
Lộ trình phê duyệt chung bao gồm bước đầu tiên là tương tác với các cơ quan quản lý lớn, sau đó là quy trình phê duyệt ở cấp quốc gia. Ở châu Âu, sự khác biệt đầu tiên trong việc triển khai lộ trình diễn ra ở cấp độ này, khi mỗi quốc gia tuân theo các quy tắc riêng của mình. Tiếp theo, có thêm một mức độ biến động trong mỗi quốc gia, khi các cơ quan quản lý khu vực kiểm soát ngân sách của riêng mình và do đó cung cấp sự chấp thuận riêng của họ đối với khả năng hoàn trả, như cũng được nêu bật trong khảo sát của chúng tôi.
Một nỗ lực hợp tác bao trùm của các tập đoàn đa bên có thể giúp khắc phục những bất bình đẳng này. Đầu tiên, việc đưa những bệnh nhân mắc BTC từ các quốc gia châu Âu khác nhau vào các thử nghiệm lâm sàng có thể tạo điều kiện cho chính quyền địa phương nhận ra tầm quan trọng của chiến lược điều trị mới. Hơn nữa, dữ liệu thực tế phản ánh dịch tễ học và kết quả của BTC ở các quốc gia khác nhau có thể giúp chính quyền địa phương xác định các nhu cầu chưa được đáp ứng. Cuối cùng, một chương trình nâng cao nhận thức toàn cầu về tỷ lệ mắc bệnh ngày càng tăng, độ tuổi chẩn đoán giảm và tác động ngày càng tăng của BTC đối với tăng trưởng kinh tế và xã hội của các quốc gia châu Âu là điều cần thiết để thúc đẩy một con đường hài hòa hơn hướng tới việc phê duyệt và triển khai các hướng dẫn.
Thông qua COST Action Precision-BTC-Network CA22125, được COST (Hợp tác khoa học và công nghệ châu Âu) hỗ trợ, liên kết với Mạng lưới nghiên cứu ung thư đường mật châu Âu (ENSCCA), có một nỗ lực quốc tế với sự đại diện của một số quốc gia châu Âu trong một chương trình hoạt động phối hợp nhằm tăng cường giáo dục về BTC, hỗ trợ chương trình nghiên cứu và cung cấp một con đường tác động đến việc triển khai các chiến lược đổi mới trong thực hành lâm sàng. Nhiệm vụ tích hợp của các mạng lưới này là tạo điều kiện thảo luận với các cơ quan quản lý để cung cấp một lộ trình thống nhất hướng tới việc phê duyệt. Dữ liệu hỗ trợ các liệu pháp nhắm mục tiêu phân tử trong BTC đến từ các nghiên cứu một nhánh, làm giảm mức độ tin cậy để phê duyệt ở cấp địa phương. Trên thực tế, việc sử dụng dữ liệu thực tế được chính thức hóa từ nhiều quốc gia châu Âu để tạo ra các nhóm đối chứng chưa qua xử lý với BTC có thể cung cấp thông tin hỗ trợ cho việc phê duyệt, miễn là con đường thu thập, làm sạch và kiểm tra dữ liệu tuân theo các quy tắc chuẩn hóa đã được thống nhất với các cơ quan quản lý.
Kết luận
Các lựa chọn điều trị cho bệnh nhân mắc BTC tiến triển gần đây đã được cải thiện và dự kiến sẽ cải thiện hơn nữa trong tương lai gần với sự chấp thuận và hoàn trả của các liệu pháp mới. Tuy nhiên, khả năng tiếp cận xét nghiệm phân tử và các phương pháp điều trị tiên tiến, chẳng hạn như liệu pháp miễn dịch và các tác nhân nhắm mục tiêu phân tử, còn lâu mới đồng nhất trong toàn châu Âu, dẫn đến bất bình đẳng trong chăm sóc sức khỏe trên khắp các quốc gia châu Âu. Việc giải quyết những bất bình đẳng này là rất quan trọng và đòi hỏi nỗ lực hợp tác toàn cầu của nhiều bên liên quan và các cơ quan quản lý nhằm thúc đẩy một con đường hài hòa hơn hướng tới việc chấp thuận, hoàn trả và triển khai các chiến lược tiên tiến trong thực hành lâm sàng. Vượt qua những thách thức trong việc tiếp cận xét nghiệm và phương pháp điều trị và giải quyết sự bất bình đẳng theo khu vực sẽ là chìa khóa để thúc đẩy việc chăm sóc và cải thiện kết quả của bệnh nhân.
Trích
New systemic treatment paradigms in advanced biliary tract cancer and variations in patient access across Europe
Rimassa, Lorenza et al.
The Lancet Regional Health – Europe, Volume 0, Issue 0, 1011
DOI: 10.1016/j.lanepe.2024.101170