Đói là bản năng sinh tồn của tổ tiên và tiến hóa; tầm quan trọng của nó thể hiện rõ ở các con đường phức tạp và trùng lặp liên quan đến cả năm giác quan điều chỉnh nó.
Theo truyền thống, khi con người còn là những người săn bắt hái lượm với nguồn cung cấp thực phẩm không thể đoán trước, việc điều chỉnh cơn đói chủ yếu liên quan đến việc duy trì sự cân bằng trao đổi chất giữa lượng calo nạp vào và lượng calo tiêu thụ. Sự ra đời của nông nghiệp cách đây 12.000 năm đã làm tăng tính sẵn có của thực phẩm giá cả phải chăng, giàu năng lượng, ngon miệng, dẫn đến tác động đáng kể đến sinh lý học tiến hóa của cơn đói vốn đã được định hình trong 2 triệu năm trước đó.
Một lượng lớn nghiên cứu cơ bản và chuyển dịch về bệnh sinh lý của cơn đói đã tiết lộ sự phức tạp của các quá trình điều chỉnh thói quen ăn uống và chịu ảnh hưởng của các yếu tố kinh tế xã hội, văn hóa, tâm lý và hành vi. Sự ổn định tương đối của trọng lượng cơ thể theo thời gian ở bất kỳ người nào cho thấy một bộ máy trao đổi chất cực kỳ tinh vi có khả năng điều chỉnh vô số biến số, cả có thể dự đoán được (ví dụ: tỷ lệ trao đổi chất cơ bản) và không thể dự đoán được (ví dụ: chất lượng và số lượng thức ăn tiêu thụ, hiệu ứng nhiệt của thực phẩm, thành phần chất dinh dưỡng đa lượng và mức độ hoạt động thể chất). Tuy nhiên, quá trình điều chỉnh chính xác này, vốn được tiến hóa để ủng hộ việc tiêu thụ quá nhiều calo (và cho phép cân bằng calo dương để tích tụ chất béo làm nguồn dự trữ năng lượng ở những người săn bắt hái lượm) hiện đang gây ra những hậu quả tiêu cực về mặt y tế.
Sinh lý học của cơn đói
Tác giả: Alessio Fasano, M.D
From the Division of Pediatric Gastroenterology and Nutrition, Mass General for Children and Harvard Medical School, Boston (A.F.); the Department of Nutrition, Harvard T.H. Chan School of Public Health, Boston (A.F.); and the European Biomedical Research Institute of Salerno, Salerno, Italy (A.F.).
Cơ chế kiểm soát cơn đói
Để hiểu được các cơ chế phức tạp đang diễn ra trong quá trình điều chỉnh cơn đói, cần phải phân biệt giữa cơn đói — động lực sinh lý để ăn được kích hoạt bởi tình trạng đói (thiếu năng lượng cấp tính) để duy trì sự cân bằng năng lượng — và sự thèm ăn, hay cơn đói khoái lạc, với lượng thức ăn nạp vào được thúc đẩy bởi khoái cảm chứ không phải bởi nhu cầu trao đổi chất.
Trong cả hai trường hợp, việc ăn uống đòi hỏi sự phối hợp tinh tế giữa não và ruột, một trong những ví dụ tinh vi nhất về sự tương tác giữa trục não và ruột. Về mặt chức năng và tiến hóa, cơn đói có thể được đặc trưng thông qua ba cơ chế riêng biệt nhưng có mối liên hệ chặt chẽ với nhau: cân bằng nội môi, khoái lạc và do hệ vi sinh vật thúc đẩy (Hình 1).
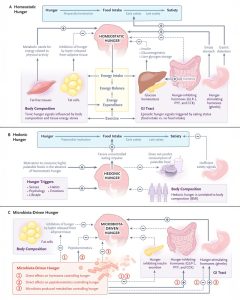
🌸ĐIỂM CHÍNH Sinh lý học của cơn đói
Cơn đói được kiểm soát bởi các mạch thần kinh nội tiết dự phòng duy trì sự cân bằng trao đổi chất.
Cơn đói cân bằng nội môi được kích hoạt bởi tình trạng thiếu thức ăn và liên quan đến các tín hiệu thần kinh nội tiết, nội tiết và trao đổi chất truyền đạt nhu cầu ăn.
Ngược lại, cơn đói khoái lạc xảy ra khi không có nhu cầu calo cấp tính. Bằng cách tăng lượng thức ăn sẵn có, nông nghiệp đã ưu tiên cơn đói khoái lạc hơn cơn đói cân bằng nội môi.
Thành phần và chức năng của hệ vi khuẩn đường ruột có thể ảnh hưởng đến các mạch thần kinh nội tiết; tuy nhiên, vai trò chính xác của chúng trong việc kiểm soát lượng thức ăn nạp vào vẫn chưa được xác định.
Kiến thức mới về sinh lý học của cơn đói cung cấp các mục tiêu điều trị mới có thể để điều chỉnh lượng thức ăn nạp vào trong các tình trạng bệnh lý, bao gồm béo phì và chán ăn tâm thần.
ĐÓI CÂN BẰNG NỘI MÔI
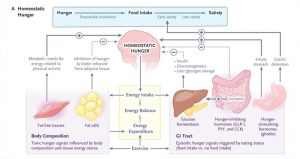
Đói cân bằng nội môi, là cơ chế kiểm soát cơn đói lâu đời nhất, liên quan đến trục não-ruột — cụ thể là trục vùng dưới đồi-ruột. Mô hình này, được Walter Cannon mô tả lần đầu tiên vào năm 1929, mô tả cơn đói là một quá trình thụ động được kích hoạt bởi sự suy giảm chất dinh dưỡng và được giảm bớt bằng cách hấp thụ chất dinh dưỡng.
Hiện nay có bằng chứng chắc chắn, ở cả mô hình động vật và con người, rằng các mạch vùng dưới đồi kiểm soát cơn đói được điều chỉnh bởi các tín hiệu cảm giác chủ yếu bắt nguồn từ đường tiêu hóa. Dạ dày rỗng kích thích cả dây thần kinh phế vị và tiết ghrelin, được coi là “hormone gây thèm ăn”. Các tín hiệu thần kinh và nội tiết hướng tâm này được truyền đến vùng dưới đồi, truyền đạt nhu cầu ăn.
Các sợi phế vị hướng tâm kích thích giải phóng dopamine, giúp tăng cường tín hiệu đói, và ghrelin làm tăng cảm giác thèm ăn thông qua việc kích hoạt thụ thể GHSR1a của nó, trong các tế bào thần kinh cảm nhận cơn đói, sản xuất axit γ-aminobutyric (GABA) của vùng dưới đồi, từ đó sản xuất peptide liên quan đến agouti (AgRP). Các tế bào thần kinh AgRP bị ức chế nhanh chóng khi cảm nhận thức ăn thông qua thị giác, khứu giác hoặc vị giác.
Ngoài ghrelin, hạ đường huyết dường như kích hoạt cơn đói bằng cách điều chỉnh hoạt động của các tế bào thần kinh vùng dưới đồi cụ thể phản ứng với nồng độ glucose trong huyết thanh. Bên cạnh các tín hiệu thần kinh nội tiết, các cơn co thắt đường tiêu hóa giai đoạn III giữa các bữa ăn do motilin gây ra dường như kiểm soát cơn đói và điều chỉnh lượng thức ăn nạp vào ở người, ở cả trạng thái khỏe mạnh và bệnh tật, thông qua con đường cholinergic. Các kích thích trong lòng, chẳng hạn như chất gây vị đắng, đã được xác định là chất điều biến giải phóng motilin, ảnh hưởng đến cơn đói và lượng thức ăn nạp vào.
Khi nạp thức ăn, một con đường phức tạp tương tự ức chế cơn đói được khởi đầu bằng sự giãn nở của dạ dày, được phát hiện bởi các thụ thể cơ học cụ thể về độ căng, độ giãn và thể tích, sau đó truyền tín hiệu đến não sau thông qua các dây thần kinh phế vị và tủy sống.
Tín hiệu no ban đầu này sau đó được củng cố bởi sự hiện diện của các axit amin và axit béo cụ thể trong đường tiêu hóa, dẫn đến ức chế cơn đói (Hình 1A).
Việc làm rỗng dạ dày, cũng như tải trọng thẩm thấu trong đường tiêu hóa, cung cấp thêm thông tin liên quan đến chất lượng và số lượng bữa ăn và góp phần vào cảm giác no sớm. Nhiều loại hormone đường tiêu hóa, chẳng hạn như peptide giống glucagon 1 (GLP-1), cholecystokinin và peptide YY (PYY), được tiết ra khi có thức ăn đã tiêu hóa trong ruột non gần và dẫn đến cảm giác no trung hạn thông qua việc tạo ra các tín hiệu ức chế trong não.
Cảm giác no muộn cuối cùng đạt được khi, khi hoàn tất các quá trình tiêu hóa, nồng độ axit amin, glucose và insulin trong huyết tương tăng lên. Sự no về mặt chuyển hóa như vậy, cùng với các tín hiệu cảm giác và sự tích hợp của tất cả các quá trình này trong hệ thần kinh trung ương (CNS), hoàn thành chu kỳ kiểm soát cơn đói cân bằng nội môi (Hình 1A).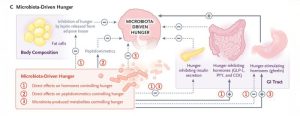
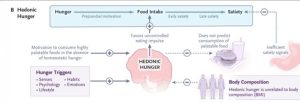
ĐÓI KHOÁI LẠC [hay là ĐÓI DO “BUỒN MIỆNG”]
Trong khi cơn đói cân bằng nội môi là điển hình của những người bị thiếu thức ăn, cơn đói khoái lạc (do khoái cảm) được đặc trưng bởi mong muốn ăn khi không có nhu cầu calo cấp tính (Hình 1B).
Trong cơn đói cân bằng nội môi, sự cân bằng đói-no được điều chỉnh chặt chẽ được điều chỉnh để duy trì cân bằng chuyển hóa, ngăn ngừa lượng calo nạp vào quá mức. Tuy nhiên, khi có đủ thức ăn, các mạch vỏ não khoái lạc hoặc phần thưởng có thể thay thế sự kiểm soát cân bằng năng lượng của vùng dưới đồi, dẫn đến việc ăn thức ăn giàu năng lượng, nhiều chất béo và nhiều đường không phải vì nhu cầu mà vì khoái cảm. Cơn đói khoái lạc cũng bị ảnh hưởng bởi cả cảm xúc tiêu cực và thường xuyên hơn là cảm xúc tích cực, dẫn đến sự khác biệt giữa các cá nhân trong hành vi ăn uống. Ví dụ, tức giận, sợ hãi, buồn bã và trầm cảm thường liên quan đến việc tiêu thụ quá nhiều đồ ngọt.
Người ta đã biết rõ rằng trẻ sơ sinh có xu hướng thích vị ngọt và mặn hơn so với vị đắng và chua, rất có thể là một phần của cơ chế thích nghi để tiêu thụ thực phẩm an toàn như sữa mẹ, vốn ngọt và kiểm soát cảm giác no tốt hơn sữa công thức dành cho trẻ sơ sinh.
Khuynh hướng thiên về đồ ăn béo, ngọt và mặn này trong bối cảnh lối sống phương Tây, trong đó tình trạng thiếu thức ăn không phải là yếu tố hạn chế, có thể một phần là nguyên nhân gây ra xu hướng béo phì, đặc biệt là ở trẻ em.
Thật vậy, cha mẹ phương Tây có xu hướng cho trẻ ăn những thực phẩm ngon miệng, giàu năng lượng (“ăn uống thoải mái”), mặc dù chúng có tác động có hại đến sức khỏe, vì lo ngại rằng những lựa chọn lành mạnh hơn về mặt dinh dưỡng như rau, trái cây hoặc thực phẩm giàu chất xơ có thể bị từ chối, dẫn đến suy dinh dưỡng.
Các kiểu ăn uống cũng bị ảnh hưởng bởi sở thích về hương vị, cũng như cảm giác thích thú trong hệ thống khen thưởng của não được kích hoạt bởi sự mong đợi được tiêu thụ những thực phẩm ngon miệng. Ngoài ra, các yếu tố kinh tế xã hội (giá thực phẩm không lành mạnh thường thấp hơn so với thực phẩm lành mạnh), tín ngưỡng văn hóa (béo phì là dấu hiệu của sức khỏe và sự giàu có ở nhiều xã hội) và các tập tục tôn giáo (hạn chế thực phẩm ở một số tôn giáo) có thể làm thay đổi cơn đói khoái lạc.
Hơn nữa, quảng cáo thực phẩm có thể kích thích giải phóng dopamine từ các vùng não liên quan đến phần thưởng và kích thích những suy nghĩ và ham muốn liên quan đến ăn uống. Ngoài ra, các cannabinoid nội sinh, các con đường opioid nội sinh và tín hiệu orexin có liên quan đến phần thưởng khoái lạc của việc ăn uống. Kết quả lâm sàng của việc tiêu thụ thực phẩm giàu calo, có giá trị cao là tăng cân quá mức (dẫn đến thừa cân hoặc béo phì), liên quan đến các rối loạn lớn, bao gồm các bệnh tim mạch, tăng huyết áp và đái tháo đường týp 2.
Thang đo sức mạnh của thực phẩm (Power of Food Scale PFS), được phát triển vào năm 2009 để định lượng cơn đói khoái lạc, đánh giá các tác động tâm lý của việc sống trong môi trường có nhiều thực phẩm và đã đưa ra những hiểu biết sâu sắc về bốn lĩnh vực liên quan. Đầu tiên, thang đo này đo chính xác động lực tiêu thụ thực phẩm ngon miệng; cả nam giới và phụ nữ có điểm PFS cao đều hướng sự chú ý thị giác của họ vào thực phẩm ngon miệng. Chụp ảnh thần kinh chức năng ở những người như vậy đã chỉ ra sự kích hoạt của các vùng xử lý trong vỏ não thị giác khi họ tiếp xúc với hình ảnh hoặc mô tả về thực phẩm ngon miệng. Ngược lại, những người có điểm PFS thấp không có cùng sự kích hoạt các mạch thần kinh kết nối các vùng liên quan đến cơn đói, sự thèm ăn và hành vi tìm kiếm thức ăn.
Thứ hai, những người có điểm PFS cao không nhất thiết phải tiêu thụ nhiều thực phẩm ngon miệng hơn, mặc dù có động lực để làm như vậy. Bằng chứng cho thấy rằng riêng cơn đói khoái lạc không đủ để dự đoán lượng thức ăn nạp vào nhưng có thể dẫn đến tình trạng tiêu thụ quá mức nếu đi kèm với các đặc điểm cá nhân khác, chẳng hạn như khả năng kiểm soát xung động kém. Do đó, cơn đói khoái lạc có lẽ chỉ liên quan yếu hoặc không nhất quán với lượng thức ăn nạp vào. Theo đó, phạm vi thứ ba, chỉ số khối cơ thể (BMI) cũng không liên quan đáng kể đến cơn đói khoái lạc. Một lời giải thích là trong một xã hội dư thừa và liên tục tiếp xúc với thức ăn ngon, mọi người nghĩ đến và thèm đồ ăn ngon, bất kể BMI của họ là bao nhiêu. Tuy nhiên, một nghiên cứu về giảm cân năm 2021 cho thấy rằng ít nhất trong một nhóm người, việc giảm cơn đói khoái lạc có liên quan đến BMI thấp hơn sau 12 tháng.
Cuối cùng, cơn đói khoái lạc được đo bằng điểm PFS có vẻ liên quan đến tình trạng ăn uống không điều độ. Các nghiên cứu hạn chế cho thấy có mối liên hệ giữa cơn đói khoái lạc và cơn ăn không kiểm soát và mức độ đói khoái lạc có liên quan đến cường độ của cơn ăn.
Trong khi cơn đói cân bằng nội môi là bản năng sinh tồn đơn giản được kích hoạt bởi một kích thích duy nhất (thiếu hụt calo cấp tính), cơn đói khoái lạc là đa yếu tố và cực kỳ phức tạp, liên quan đến việc học tập, nhận thức và trí nhớ. Do đó, cơn đói khoái lạc rất khó giải quyết trên cơ sở dân số nhưng nên tiếp cận bằng cách sử dụng các chiến lược cá nhân hóa dựa trên yếu tố (hoặc các yếu tố) đang diễn ra ở bất kỳ người nào.
CƠN ĐÓI DO VI SINH VẬT ĐIỀU KHIỂN
Hệ vi sinh vật đường ruột là cộng sinh cung cấp cho vật chủ khả năng bảo vệ khỏi các tác nhân gây bệnh và góp phần lập trình hệ thống miễn dịch và kiểm soát các chức năng trao đổi chất quan trọng, bao gồm cả quá trình trao đổi chất năng lượng. Ngoài ra, hệ vi sinh vật cung cấp năng lượng cho vật chủ thông qua việc giải phóng các enzyme và chất chuyển hóa dinh dưỡng (ví dụ: axit béo chuỗi ngắn).
Vì cơn đói phụ thuộc rất nhiều vào quá trình giao tiếp hai chiều giữa ruột và não, nên hệ vi sinh vật đường ruột cũng ảnh hưởng đến các mạch đói của vật chủ. Một số cơ chế liên quan đến cả con đường toàn thân và thần kinh, thông qua việc ảnh hưởng gián tiếp đến cơn đói thông qua hormone hoặc bằng cách sản xuất các chất chuyển hóa ảnh hưởng trực tiếp đến cơn đói, đã được làm sáng tỏ.
Hầu hết các nghiên cứu trong lĩnh vực này đều mang tính mô tả, liên quan đến mô hình động vật hoặc dựa trên các nghiên cứu lâm sàng cắt ngang với quy mô mẫu nhỏ.
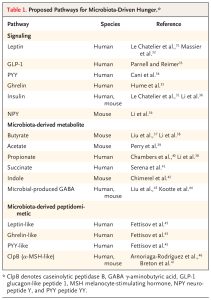
Các thử nghiệm lâm sàng nhằm điều chỉnh hệ vi khuẩn đường ruột để giảm cơn đói như một phương tiện kiểm soát cân nặng đã tạo ra dữ liệu mâu thuẫn. Do đó, vai trò chính xác của hệ vi khuẩn trong việc ảnh hưởng đến cơn đói của vật chủ là con người cần được làm rõ hơn. Một số ví dụ về các cơ chế liên quan đến cơn đói do hệ vi khuẩn thúc đẩy được xem xét dưới đây và các cơ chế cụ thể theo loài được đề xuất được liệt kê trong Bảng 1.
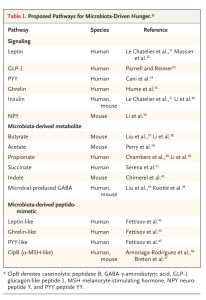
TÁC ĐỘNG CỦA VI SINH VẬT LÊN CÁC HORMONE KIỂM SOÁT CẢM GIÁC ĐÓI Ở NGƯỜI
Các vi sinh vật có khả năng ảnh hưởng đến việc giải phóng các hormone kiểm soát cơn đói (ví dụ như ghrelin, leptin và insulin) do ruột, mô mỡ và tuyến tụy sản xuất (Hình 1C). Giảm sự đa dạng của hệ vi khuẩn đường ruột (một dấu hiệu của chứng loạn khuẩn) có liên quan đến nồng độ leptin huyết thanh cao hơn ở cả người gầy và người béo phì.
Ở những người béo phì, tính thấm ruột tăng có thể tạo điều kiện cho các thành phần của hệ vi khuẩn đường ruột đi qua vào mô mỡ của vật chủ, làm thay đổi quá trình chuyển hóa năng lượng thông qua ức chế tín hiệu leptin và dẫn đến chứng rối loạn đường huyết và trong một số trường hợp là bệnh tiểu đường loại 2.
Prebiotic từ hệ vi khuẩn đường ruột, bao gồm inulin và oligofructose, dường như ức chế cơn đói bằng cách tăng tổng hợp GLP-1 và PYY trong khi đồng thời ức chế sản xuất ghrelin ở cả người lớn gầy và người béo phì.33,34 Tuy nhiên, trong các nghiên cứu liên quan đến trẻ em bị béo phì, việc bổ sung inulin giàu oligofructose dẫn đến giảm lượng thức ăn nạp vào, điều này có liên quan đến nồng độ ghrelin tăng lên sau đó nhưng không ảnh hưởng đến GLP-1, PYY hoặc các con đường insulin.
Giống như leptin và ghrelin, insulin có thể điều chỉnh cơn đói bằng cách tác động đến các tế bào thần kinh AgRP48 và có thể bị ảnh hưởng bởi hệ vi khuẩn đường ruột. Thật vậy, sự đa dạng của vi khuẩn đường ruột giảm đi có liên quan đến tình trạng kháng insulin tăng lên.31 Ngoài ra, trong một nghiên cứu liên quan đến chuột béo phì, men vi sinh đã thay đổi thành phần vi khuẩn đường ruột và ức chế cơn đói bằng cách giảm tình trạng kháng insulin và ức chế biểu hiện neuropeptide Y.36 Kết quả không nhất quán giữa các nghiên cứu liên quan đến người lớn và trẻ em có thể là do sự khác biệt liên quan đến độ tuổi nhưng rất có thể là do sự khác biệt trong thiết kế và diễn giải nghiên cứu.
CÁC CHẤT CHUYỂN HÓA CÓ NGUỒN GỐC TỪ VI SINH VẬT KIỂM SOÁT CẢM GIÁC ĐÓI
Các chất chuyển hóa có nguồn gốc từ vi sinh vật (postbiotic) là chất trung gian truyền tín hiệu chính của trục vi sinh vật đường ruột-não và góp phần gây ra cơn đói. Các axit béo chuỗi ngắn, bao gồm butyrat, propionat và axetat, là sản phẩm sinh học của quá trình lên men vi khuẩn của các polysaccharide khó tiêu hóa (ví dụ: chất xơ). Sau khi liên kết với thụ thể axit béo tự do 3 và thụ thể liên kết với protein G 41 trong các đảo tụy, các axit béo chuỗi ngắn có khả năng kích thích cơn đói cân bằng nội môi bằng cách ủng hộ tín hiệu liên quan đến ghrelin và ức chế tiết insulin. Tuy nhiên, cũng có bằng chứng cho thấy axit béo chuỗi ngắn có thể ức chế cơn đói bằng cách liên kết với thụ thể axit béo tự do 2 và thụ thể liên kết với protein G 43, có thể dẫn đến giải phóng GLP-1, PYY, insulin và leptin. Bên cạnh việc kích thích cơn đói cân bằng nội môi, axit béo chuỗi ngắn — và cụ thể là propionate đại tràng — có thể làm giảm cơn đói khoái lạc thông qua ức chế các mạch tưởng thưởng của CNS.Cuối cùng, acetate do vi khuẩn đại tràng tạo ra có thể vượt qua hàng rào máu não và trực tiếp ức chế các tế bào thần kinh AgRP ở vùng dưới đồi.
Succinate là một sản phẩm sinh học khác của vi khuẩn đại tràng có thể ảnh hưởng đến cân bằng năng lượng của vật chủ thông qua kiểm soát cơn đói. Một nghiên cứu cho thấy những người béo phì có mức succinate lưu thông tăng lên và các biện pháp can thiệp vào chế độ ăn uống để giảm cân ở những người như vậy có liên quan đến những thay đổi trong thành phần vi khuẩn đường ruột và làm giảm nồng độ succinate lưu thông.Tuy nhiên, các thí nghiệm trên mô hình động vật đã mang lại kết quả không nhất quán.
Indole, một chất chuyển hóa khác có nguồn gốc từ vi khuẩn đường ruột, có thể ức chế cơn đói bằng cách kích thích giải phóng GLP-1. Ngoài ra, một nghiên cứu cho thấy indole kích thích sản xuất tryptophan, từ đó gây ra giải phóng 5-hydroxytryptamine từ các tế bào nội tiết ruột. Nhiều nghiên cứu đã chỉ ra rằng 5-hydroxytryptamine đóng vai trò quan trọng trong việc ức chế cơn đói bằng cách cải thiện độ nhạy insulin và ảnh hưởng đến các tế bào thần kinh AgRP.
Vi khuẩn đường ruột cũng sản xuất GABA từ glutamate trong chế độ ăn uống. GABA là một trong những phân tử chính làm trung gian cho quá trình giao tiếp giữa ruột và não, bao gồm kiểm soát cơn đói thông qua việc kích hoạt các tế bào thần kinh AgRP. Những người bị béo phì có ít vi sinh vật đường ruột lên men glutamate hơn, với sự gia tăng tương ứng về mức độ glutamate lưu thông, những phát hiện xác nhận vai trò của glutamate trong cân bằng năng lượng đã được chứng minh ở các mô hình động vật.
PEPTIDOMIMETICS KIỂM SOÁT CƠN ĐÓI CÓ NGUỒN GỐC TỪ VI SINH VẬT
Một số nghiên cứu đã chỉ ra rằng hệ vi sinh đường ruột có thể sản xuất ra các protein (được phân loại là peptidomimetics) mô phỏng cấu trúc và chức năng của các protein kiểm soát cơn đói như PYY, ghrelin và leptin. Một trong những ví dụ tốt nhất về peptidomimetics của vi khuẩn là peptidase B phân giải casein (ClpB), do Escherichia coli sản xuất, có tác dụng tương tự như hormone kích thích tế bào hắc tố α (α-MSH) ức chế cơn đói do vật chủ người sản xuất.46 Cụ thể, các mô hình động vật trong cơ thể sống đã chỉ ra rằng giống như α-MSH, ClpB làm tăng nồng độ GLP-1 và PYY trong huyết thanh và kích hoạt các tế bào thần kinh vùng dưới đồi ức chế cơn đói. Những dữ liệu này cho thấy hệ vi sinh đường ruột cũng có thể ức chế cơn đói thông qua các peptidomimetics cụ thể.
Kiểm soát cơn đói bởi gene di truyền
Mặc dù tác động của các yếu tố kinh tế xã hội, tâm lý và văn hóa lên hành vi ăn uống là rõ ràng, nhưng vai trò của di truyền trong việc ảnh hưởng đến sở thích về thực phẩm, khẩu vị, chất lượng và số lượng thức ăn tiêu thụ dường như không đơn giản.
Tuy nhiên, có một số ví dụ về các rối loạn đơn gen hiếm gặp gây ra chứng ăn nhiều và béo phì.62 Hội chứng Prader–Willi, một tình trạng di truyền liên quan đến việc mất đoạn vùng 11-13q của nhiễm sắc thể 15, là ví dụ điển hình của một rối loạn di truyền có thể gây ra cơn đói không thể kiểm soát và phát triển thành bệnh béo phì nghiêm trọng trong thời thơ ấu.
Trẻ em mắc hội chứng Prader–Willi có các biến chứng của bệnh béo phì nghiêm trọng, bao gồm bệnh tiểu đường loại 2 và suy tim, và chúng hiếm khi sống sót sau 25 đến 30 tuổi. Các biến thể di truyền mất chức năng của gen leptin (LEP) trên nhiễm sắc thể 7q31.3 hoặc thụ thể của nó (LEPR) cũng dẫn đến hành vi ăn uống bất thường, dẫn đến béo phì nghiêm trọng, khởi phát sớm. Những dạng béo phì di truyền hiếm gặp này xác nhận vai trò quan trọng của các con đường cụ thể trong kiểm soát cơn đói và cân bằng nội môi. Tuy nhiên, các dạng béo phì đơn gen chỉ chiếm chưa đến 7% các trường hợp béo phì ở trẻ em.
Hậu quả của các mạch gây rối loạn đói
Một hệ quả của mạng lưới phức tạp và dư thừa kiểm soát cơn đói và cảm giác no là sự rối loạn của các mạch có thể dẫn đến các rối loạn ăn uống, từ ăn không đủ (chán ăn) đến ăn quá nhiều (ăn nhiều, béo phì và các rối loạn chuyển hóa liên quan như đái tháo đường týp 2). Sự quan tâm ngày càng tăng đối với thần kinh học của các rối loạn này được thúc đẩy bởi tác động ngày càng tăng của chúng đối với sức khỏe cộng đồng.
Hạn chế lượng thức ăn nạp vào không phù hợp và nghiêm trọng, dẫn đến giảm cân nguy hiểm và lập trình lại quá trình trao đổi chất, là những đặc điểm quan trọng của chứng chán ăn tâm thần, một tình trạng ảnh hưởng đến một số lượng lớn bệnh nhân, đặc biệt là trẻ em gái và phụ nữ trẻ, ở các nước công nghiệp hóa. Các hành vi được thấy ở những bệnh nhân mắc chứng chán ăn tâm thần có thể được khái niệm hóa như một dạng cực đoan của quá trình thích nghi chuyển hóa với tình trạng đói. Thật vậy, để duy trì các chức năng sinh học tối quan trọng cho sự sống còn (ví dụ, oxy hóa não và cung cấp máu cho tim), có cả sự tái lập trình trung tâm và ngoại vi của tín hiệu nội tiết và thần kinh kiểm soát sự cân bằng năng lượng, tập thể dục, sinh học sinh sản, chuyển hóa xương và hành vi ăn uống.
Nghịch lý thay, mức ghrelin tăng lên ở những bệnh nhân chán ăn tâm thần, điều này cho thấy việc hạn chế thức ăn mãn tính dẫn đến những nỗ lực bù trừ để kích thích cơn đói.
Tại sao sự thích nghi bù trừ thích hợp này không chuyển thành cơn đói tăng lên vẫn chưa được biết, nhưng sự vô cảm tạm thời với ghrelin và lập trình lại quá trình trao đổi chất đã được đề xuất. Nghịch lý này đã tạo ra sự quan tâm lớn và cuối cùng có thể dẫn đến mục tiêu cho các chiến lược điều trị.
Ngoài tín hiệu ngoại vi bất thường, những bệnh nhân mắc chứng chán ăn tâm thần có chức năng não thay đổi, đặc trưng bởi sự thiếu hụt tiết dopamine và serotonin, lần lượt kiểm soát hành vi ăn uống hoặc phần thưởng và kiểm soát xung lực hoặc chứng loạn thần kinh. Hơn nữa, những bệnh nhân chán ăn tâm thần có sự kích hoạt không phù hợp của hệ thống corticolimbic, hệ thống kiểm soát sự thèm ăn và sợ hãi, và hoạt động giảm của các mạch trán-vân, hệ thống điều chỉnh các hành vi theo thói quen. Phân tích hệ vi sinh vật trong phân và hồ sơ chuyển hóa ở những bệnh nhân chán ăn tâm thần đã phát hiện ra sự khác biệt về thành phần và tính đa dạng của hệ vi sinh vật đường ruột khi so sánh với nhóm đối chứng khỏe mạnh. Ngoài ra, cả mô hình động vật và các nghiên cứu lâm sàng đều cho thấy chứng loạn khuẩn đường ruột, bằng cách làm tăng tính thấm của ruột, có thể ảnh hưởng đến sự phát triển của các rối loạn ăn uống liên quan đến việc vận chuyển quá mức ClpB và lipopolysaccharide từ lòng ruột vào tuần hoàn toàn thân.
Tiêu thụ quá nhiều thức ăn, như đã thảo luận ở trên, đang trở thành một vấn đề sức khỏe cộng đồng lớn. Theo Tổ chức Y tế Thế giới, cứ tám người trên toàn thế giới thì có một người bị béo phì vào năm 2022 và trong 30 năm qua, tỷ lệ béo phì đã tăng gấp đôi ở người lớn và tăng gấp bốn lần ở thanh thiếu niên. Dữ liệu từ nhóm trẻ em đặc biệt đáng báo động; trên toàn thế giới, 37 triệu trẻ em dưới 5 tuổi và hơn 390 triệu trẻ em và thanh thiếu niên từ 5 đến 19 tuổi bị thừa cân hoặc béo phì.76 Những người bị béo phì, bất kể tuổi tác, đều có nguy cơ mắc nhiều bệnh nghiêm trọng và tình trạng sức khỏe, bao gồm huyết áp cao, đái tháo đường týp 2, viêm xương khớp, các vấn đề về tâm lý (ví dụ: lo lắng, trầm cảm và tác động của bắt nạt và kỳ thị) và lòng tự trọng thấp, so với những người có cân nặng khỏe mạnh. Ngoài ra, béo phì và các vấn đề sức khỏe liên quan đến nó có tác động kinh tế đáng kể trên toàn thế giới, với chi phí chăm sóc y tế liên quan đến béo phì ước tính là 173 tỷ đô la mỗi năm tại Hoa Kỳ.
Nhiều chương trình chăm sóc sức khỏe, dinh dưỡng, thể chất, xã hội, kinh tế và giáo dục cho đến nay vẫn chưa tác động đến tỷ lệ béo phì đang gia tăng trên toàn thế giới. Tuy nhiên, những khám phá mới về thần kinh học về cơn đói đã dẫn đến sự phát triển của các biện pháp dược lý tiềm năng cho vấn đề này. Ví dụ nổi bật nhất là việc sử dụng các chất chủ vận thụ thể GLP-1 trong hai thập kỷ qua, bắt đầu với sự chấp thuận ban đầu của Cục Quản lý Thực phẩm và Dược phẩm vào năm 2005. Các chất chủ vận thụ thể GLP-1 đã được chứng minh là cải thiện khả năng kiểm soát lượng đường trong máu, giảm nguy cơ mắc bệnh tim ở những bệnh nhân béo phì và giúp những bệnh nhân thừa cân hoặc béo phì giảm cân bằng cách ức chế cơn đói.
Tuy nhiên, việc những người nổi tiếng, vận động viên và đáng lo ngại nhất là thanh thiếu niên sử dụng các chất này trong mỹ phẩm mà không có chỉ định y khoa có thể dẫn đến những tác dụng phụ lâu dài không mong muốn. Riêng đối với trẻ em, các chất chủ vận thụ thể GLP-1 đã được chứng minh là ảnh hưởng tiêu cực đến sự tăng trưởng và phát triển, vì chúng có thể gây mất cân bằng lâu dài giữa lượng năng lượng nạp vào và năng lượng tiêu hao, ức chế sự thèm ăn, có tác dụng chống khoái cảm và gây mệt mỏi. Những thay đổi này có thể chuyển thành sự mất cân bằng không phù hợp giữa lượng năng lượng nạp vào và năng lượng tiêu hao trong giai đoạn phát triển quan trọng mà lượng calo không chỉ cần thiết cho các hoạt động hàng ngày mà còn cần thiết cho sự tăng trưởng. Hơn nữa, có một số báo cáo về việc sử dụng sai chất chủ vận thụ thể GLP-1 ở trẻ em mắc chứng rối loạn ăn uống và ở thanh thiếu niên tham gia các môn thể thao cạnh tranh với các nhóm cạnh tranh dựa trên trọng lượng cơ thể.
Ý nghĩa
Trong vài năm qua, chúng ta đã có được kiến thức đáng kể về sinh lý học của cơn đói, mở ra khả năng điều trị cá nhân hóa, chiến lược sức khỏe dựa trên dân số và can thiệp phòng ngừa. Tại Hoa Kỳ, chi tiêu hàng năm bao gồm 800 tỷ đô la cho thực phẩm (30% trong số đó bị lãng phí), 14 tỷ đô la cho quảng cáo thực phẩm và 456 triệu đô la cho sức khỏe và thể dục, tổng cộng là 814,5 tỷ đô la cho thực phẩm và chi phí liên quan đến thực phẩm. Ngoài ra, chi phí cho các loại thuốc mới để kiểm soát cân nặng, chẳng hạn như thuốc chủ vận thụ thể GLP-1, gần như chắc chắn sẽ làm tăng thêm chi phí liên quan đến chế độ ăn uống. Theo Viện Nghiên cứu Chính sách Thực phẩm Quốc tế, cần 100 tỷ đô la mỗi năm để chấm dứt nạn đói trên thế giới, bằng một phần tám chi phí liên quan đến thực phẩm tại Hoa Kỳ. Những thay đổi về chính sách hướng đến giải quyết nạn đói có thể giải quyết nhiều vấn đề sức khỏe liên quan đến dinh dưỡng và giúp sản xuất thực phẩm bền vững hơn và phân phối công bằng hơn để mang lại lợi ích cho cả các nước công nghiệp hóa và đang phát triển.
Tóm tắt và Kết luận
Các cơ chế chi phối sinh lý học của cơn đói là đa chiều, phức tạp và vẫn chưa được xác định đầy đủ. Tiến bộ đạt được trong lĩnh vực này trong vài năm qua đã cho phép chúng ta đánh giá một số cơ chế đang hoạt động và tác động của những thay đổi tiến hóa, đặc biệt liên quan đến việc mua thực phẩm, đối với bệnh sinh lý của lượng thức ăn tiêu thụ. Bây giờ chúng ta nên tận dụng kiến thức này để phát triển các biện pháp can thiệp và phòng ngừa được cá nhân hóa nhằm thúc đẩy sự cân bằng trao đổi chất và cuối cùng là sức khỏe tốt.
Trích N Engl J Med 2025;392:372-381
DOI: 10.1056/NEJMra2402679
VOL. 392 NO. 4