📊Tiêm dưới da kháng thể đơn dòng để ngăn ngừa bệnh sốt rét
Tác giả:
Kassoum Kayentao, M.D., Ph.D.,M.P.H.,
Aissata Ongoiba, M.D., M.P.H.,
Anne C. Preston, R.N.,
Sara A. Healy, M.D., M.P.H.,
Zonghui Hu, Ph.D.,
Jeff Skinner, M.S.,
Safiatou Doumbo, M.D., Ph.D., +36,
cho Nhóm thử nghiệm mAb sốt rét ở Mali
Published April 26, 2024
N Engl J Med 2024;390:1549-1559
DOI: 10.1056/NEJMoa2312775
🪻Tóm tắt
Năm 2021, Tổ chức Y tế Thế giới (WHO) khuyến nghị sử dụng vắc xin RTS,S/AS01 cho trẻ em; 4 liều vắc-xin có hiệu quả chống lại bệnh sốt rét là 36% trong thời gian 4 năm ở trẻ em từ 5 đến 17 tháng tuổi. WHO gần đây cũng đã phê duyệt vắc-xin R21/Matrix-M để sử dụng cho trẻ em.
Tại những địa điểm có mùa sốt rét quanh năm, phòng ngừa bằng miễn dịch là biện pháp chăm sóc tiêu chuẩn trong mùa sốt rét kéo dài 4 đến 6 tháng, phác đồ 3 liều vắc xin R21/Matrix-M có hiệu quả 75% trong khoảng thời gian 12 tháng ở trẻ em từ 5 đến 36 tháng tuổi, và cần tiêm nhắc lại sau 12 tháng để duy trì hiệu quả.
Khi tiêm theo mùa, vắc xin RTS,S/AS01 và R21/Matrix-M có hiệu quả tương tự.
WHO cũng khuyến cáo miễn dịch dự phòng sốt rét ở những nhóm có nguy cơ cao, chẳng hạn như trẻ sơ sinh và trẻ nhỏ, trẻ em bị thiếu máu nặng sau khi xuất viện có nguy cơ mắc bệnh sốt rét gây tử vong và người mang thai. Mặc dù miễn dịch dự phòng sốt rét là an toàn và hiệu quả ở trẻ em và người mang thai, đạt được mức độ bao phủ cao với các phác đồ sử dụng thường xuyên là một thách thức.
Các loại thuốc mới, bao gồm kháng thể đơn dòng, ngăn ngừa bệnh sốt rét đến 6 tháng sau khi dùng một liều duy nhất có thể cải thiện phạm vi phòng ngừa trong những nhóm dân cư dễ bị tổn thương này.
Trong thử nghiệm giai đoạn 2 trên người trưởng thành ở Mali, người ta tiêm truyền tĩnh mạch CIS43LS, một kháng thể đơn dòng có thời gian bán hủy kéo dài nhắm vào epitope nối được bảo tồn trên protein P. falciparum Circumsporozoite (PfCSP), với liều 10 mg mỗi kg trọng lượng cơ thể hoặc 40 mg/kg.
Trong mùa sốt rét kéo dài 6 tháng, kháng thể đơn dòng này mang lại hiệu quả bảo vệ chống lại nhiễm trùng P. falciparum là 75,0% và 88,2% ở liều lần lượt là 10 mg/kg và 40 mg/kg.
Tiếp theo những kết quả này là sự phát triển của L9LS, một kháng thể đơn dòng có thời gian bán hủy kéo dài nhắm vào một epitop PfCSP nối được bảo tồn cao khác, mạnh hơn CIS43LS trong các mô hình tiền lâm sàng.
Trong thử nghiệm giai đoạn 1, L9LS bảo vệ người trưởng thành chống lại bệnh sốt rét được kiểm soát nhiễm trùng, bao gồm cả bốn trong số năm người trưởng thành đã tiêm L9LS với liều 5 mg/kg dưới da. Ở đây, nhóm tác giả báo cáo kết quả của một thử nghiệm giai đoạn 2 được thực hiện ở Mali để đánh giá tính an toàn và hiệu quả của việc tiêm L9LS dưới da chống lại Nhiễm P. falciparum ở trẻ khỏe mạnh từ 6 đến 10 tuổi trong mùa sốt rét kéo dài 6 tháng.
Tiêm dưới da kháng thể đơn dòng L9LS bảo vệ người lớn khỏi nhiễm trùng Plasmodium falciparum được kiểm soát trong thử nghiệm giai đoạn 1. Liệu một kháng thể đơn dòng được tiêm dưới da có thể bảo vệ trẻ em khỏi nhiễm P. falciparum ở khu vực nơi sinh vật này lưu hành hay không vẫn chưa rõ ràng.
🍀PHƯƠNG PHÁP
Nhóm tác giả đã tiến hành thử nghiệm giai đoạn 2 ở Mali để đánh giá tính an toàn và hiệu quả của việc tiêm L9LS dưới da ở trẻ em từ 6 đến 10 tuổi trong mùa sốt rét kéo dài 6 tháng.
Thử nghiệm được thực hiện theo hướng dẫn Thực hành lâm sàng tốt của the International Council for Harmonisation và các quy định của Malian. Cục Quản lý Thực phẩm và Dược phẩm FDA đã xem xét quy trình thử nghiệm trong đơn đăng ký thuốc mới đang nghiên cứu (số 160213). Cuộc thử nghiệm được tài trợ bởi Viện Dị ứng và Bệnh Truyền nhiễm Quốc gia. Quy trình và mẫu đơn đồng ý đã được phê duyệt bởi Faculté de Médecine et d’Odonto-Stomatologie và ủy ban đạo đức Faculté de Pharmacie tại Đại học Khoa học, Kỹ thuật và Công nghệ Bamako, ở Bamako, Mali và bởi các cơ quan quản lý của Malian.
Đã có sự cho phép của cộng đồng và có sự đồng ý bằng văn bản từ tất cả người lớn và từ tất cả cha mẹ hoặc người giám hộ của trẻ em.
Một ban giám sát dữ liệu và an toàn đã xem xét quy trình thử nghiệm và các tài liệu đồng ý, xem xét các tác dụng phụ và tiến hành đánh giá an toàn tạm thời sau khi đáp ứng các tiêu chí an toàn chính cho phần A của thử nghiệm và trước khi phần B bắt đầu.
Các tác giả đảm bảo tính chính xác và đầy đủ của dữ liệu cũng như tính trung thực của thử nghiệm đối với giao thức.
🌼THUỐC THỬ NGHIỆM
L9LS là kháng thể đơn dòng IgG1 ở người được sản xuất theo tiêu chuẩn GMP hiện hành bằng phương pháp nuôi cấy tế bào trong dòng tế bào buồng trứng tái tổ hợp của chuột đồng Trung Quốc. Các quy trình và phương pháp phân tích đã được phát triển tại Chương trình Sản xuất Vắc xin của Cơ quan này Trung tâm Nghiên cứu Vắc xin và chuyển giao cho Chương trình Vật liệu Lâm sàng Vắc xin (vận hành theo hợp đồng với Leidos Biomedical Research) để sản xuất theo Quy trình GMP hiện hành.
L9LS được cho vào lọ ở môi trường đệm ở nồng độ 150 mg/ml.
🌼THỬ NGHIỆM LÂM SÀNG
🚩Thử nghiệm giảm dần độ tuổi và tăng liều (Phần A)
Đối với phần A, các tác giả đã xác định trước rằng 18 người lớn sẽ được chỉ định theo kiểu nhãn mở để nhận L9LS với liều 300 mg hoặc 600 mg, tiêm dưới da hoặc 20 mg cho mỗi kg trọng lượng cơ thể, tiêm tĩnh mạch; mỗi nhóm có 6 người tham gia.
Việc tiêm kháng thể bắt đầu ở nhóm liều thấp nhất (nhóm nhận 300 mg tiêm dưới da) và khi người tham gia đến ngày thứ 7 sau khi tiêm, việc tiêm sẽ bắt đầu ở mức liều tiếp theo nếu không có lo ngại nào về an toàn.
Sau khi người lớn tham gia cuối cùng trong nhóm dùng liều cao nhất (nhóm nhận liều tiêm tĩnh mạch) đến ngày thứ 7 sau khi truyền, 18 trẻ em được phân định ngẫu nhiên (theo tỷ lệ 1:1) để nhận 150 mg L9LS hoặc giả dược nước muối bình thường, tiêm dưới da. Nếu không có lo ngại nào về an toàn xuất hiện sau khi tất cả những người tham gia trong nhóm đó đến ngày thứ 7 sau khi tiêm, thì thêm 18 trẻ được chọn ngẫu nhiên (theo tỷ lệ 1:1) để nhận 300 mg L9LS hoặc giả dược, tiêm dưới da.
Trong phần A, việc phân tầng theo trọng lượng cơ thể được sử dụng để phân loại tất cả 36 trẻ (26 đến 30 kg, 20 đến 25 kg hoặc 15 đến 19 kg, với 12 trẻ tham gia vào mỗi tầng, như đã được xác định trước).
Những người tham gia và thành viên nhóm thử nghiệm không biết về nhiệm vụ của nhóm thử nghiệm; chỉ có dược sĩ thử nghiệm mới biết được nhiệm vụ. Chi tiết về quy trình quản lý được cung cấp trong Phụ lục bổ sung. Người lớn được theo dõi về độ an toàn vào các ngày 1, 3, 7, 14, 21 và 28, sau đó hàng tháng trong suốt 28 tuần sau khi dùng thuốc, và trẻ em được theo dõi vào các ngày 1, 3, 7, 14, 21 và 28 và sau đó cứ 2 tuần một lần cho đến hết 28 tuần sau khi dùng thuốc.
Trong cả hai phần A và B của thử nghiệm, dữ liệu về các tác dụng phụ cục bộ và toàn thân được yêu cầu đã được ghi lại trong 7 ngày sau khi dùng L9LS hoặc giả dược và các đánh giá trong phòng thí nghiệm được thu thập trong 14 ngày.
Trong cả hai phần A và B, dữ liệu về các tác dụng phụ không mong muốn, bao gồm cả các tác dụng phụ nghiêm trọng, được thu thập trong suốt thời gian thử nghiệm. Tất cả các biến cố bất lợi đều được theo dõi thông qua việc giải quyết và mối quan hệ nhân quả được xác định bởi các bác sĩ lâm sàng thử nghiệm. Sau khi trẻ em tham gia cuối cùng trong nhóm dùng liều cao nhất (nhóm nhận liều 300 mg) đạt đến ngày thứ 7 của quá trình theo dõi về độ an toàn, đánh giá an toàn tạm thời được thực hiện trước khi bắt đầu đăng ký vào phần B.
🚩Thử nghiệm ngẫu nhiên, có đối chứng giả dược (Phần B)
Trẻ em được phân ngẫu nhiên (theo tỷ lệ 1:1:1) bằng phương pháp chọn ngẫu nhiên theo khối để nhận 150 mg L9LS, 300 mg L9LS hoặc giả dược nước muối thông thường.
L9LS hoặc giả dược được tiêm dưới da.
Việc ngẫu nhiên hóa được phân tầng theo trọng lượng cơ thể (26 đến 30 kg, 20 đến 25 kg hoặc 15 đến 19 kg, với 75 người tham gia trong mỗi tầng).
Chỉ có dược sĩ tham gia thử nghiệm mới biết được nhiệm vụ của nhóm. Những người tham gia được nhận L9LS hoặc giả dược (ngày 0) và được theo dõi vào các ngày 1, 3, 7, 14, 21 và 28 và 2 tuần một lần sau đó trong suốt 24 tuần.
📌Đánh giá ban đầu bao gồm kiểm tra thể chất và phát hiện P. falciparum bằng cách kiểm tra phết máu bằng kính hiển vi.
Điểm cuối về hiệu quả chính là nhiễm trùng P. falciparum trong giai đoạn máu (bất kể sự hiện diện của các triệu chứng) được phát hiện bằng phương pháp kiểm tra bằng kính hiển vi các mẫu phết máu dày thu được ít nhất 2 tuần một lần trong các lần thăm khám thử nghiệm theo lịch trình và các lần khám bệnh đột xuất. Các vết máu không được đọc vào thời điểm chúng được lấy trừ khi có dấu hiệu hoặc triệu chứng của bệnh sốt rét.
Sốt rét lâm sàng (điểm cuối về hiệu quả thứ cấp) được phát hiện trong các lần khám định kỳ và đột xuất. Định nghĩa đầu tiên về bệnh sốt rét lâm sàng (định nghĩa 1) là nhiệt độ cơ thể ít nhất là 37,5°C hoặc có tiền sử sốt trong 24 giờ trước đó và ký sinh trùng vô tính P. falciparum có hơn 5000 ký sinh trùng trên mỗi milimét khối; định nghĩa thứ hai về bệnh sốt rét lâm sàng (định nghĩa 2) là một căn bệnh kèm theo bất kỳ mức độ nhiễm ký sinh trùng vô tính P. falciparum nào dẫn đến việc phải điều trị bằng thuốc chống sốt rét.
Tất cả những người tham gia đều nhận được một liệu trình điều trị được quan sát trực tiếp bằng artemether–lumefantrine từ 7 đến 12 ngày trước khi dùng L9LS hoặc giả dược để loại bỏ khả năng nhiễm P. falciparum để có thể đánh giá điểm cuối hiệu quả chính.
Trong thời gian còn lại của thử nghiệm, các ca nhiễm P. falciparum không có triệu chứng không được điều trị theo hướng dẫn quốc gia ở Mali. Tất cả những người tham gia có triệu chứng sốt rét diễn tiến đều được điều trị tiêu chuẩn.
📝KẾT QUẢ
🚩NHỮNG NGƯỜI THAM GIA
Từ ngày 18/3 đến ngày 10/8 năm 2022, tổng cộng 24 người lớn từ 18 đến 55 tuổi và 341 trẻ em từ 6 đến 10 tuổi đã được đánh giá đủ điều kiện. 5 người lớn đã bị loại vì họ không đủ điều kiện, và 19 người lớn còn lại được ghi danh vào phần A của thử nghiệm và nhận được thuốc artemether–lumefantrine.
Tổng cộng có 73 trẻ bị loại vì không đủ điều kiện (54), vì chúng đóng vai trò dự phòng và không cần thiết (17), hoặc vì các lý do khác (2).
268 em còn lại được ghi danh vào phần A hoặc B.
📌Trong pha A của người lớn, 1 trong số 19 người tham gia đã đăng ký đã không tiếp tục sử dụng L9LS vì đã đạt đến cỡ mẫu quy định trước là 18. Từ ngày 30/3 đến ngày 23/4 năm 2022, tổng cộng 18 người trưởng thành đã nhận được L9LS trong ba nhóm tăng liều: 300 mg tiêm dưới da, 600 mg tiêm dưới da hoặc 20 mg mỗi kg tiêm tĩnh mạch, với 6 người tham gia trong mỗi nhóm.
Đặc điểm của những người tham gia này tại thời điểm ban đầu được thể hiện trong Bảng S1.Tất cả 18 người lớn tham gia đã hoàn thành các đợt thăm khám thử nghiệm cho đến ngày thứ 196.
📌Trong pha A ở trẻ em, 5 trong số 41 người tham gia đã không được phân ngẫu nhiên vì họ là những người dự phòng và không cần thiết (4) hoặc vì các tiêu chí loại trừ đã được đáp ứng trước khi phân ngẫu nhiên (1). Từ ngày 3/5 đến ngày 17/5 năm 2022, tổng cộng 36 trẻ em được chọn ngẫu nhiên và nhận giả dược hoặc L9LS, tiêm dưới da, thuộc một trong hai nhóm tăng liều: 9 trẻ nhận 150 mg L9LS, 9 trẻ nhận 300 mg L9LS và 18 trẻ nhận được giả dược.
Đặc điểm của những người tham gia này tại thời điểm ban đầu được thể hiện trong Bảng S2.
Tất cả 36 trẻ tham gia đều đã hoàn thành các chuyến thăm khám thử nghiệm cho đến ngày thứ 196.
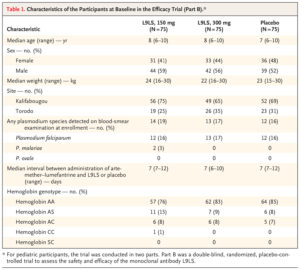
Khi tham gia NC, P.falciparum được phát hiện qua xét nghiệm máu ở 12 người tham gia (16%) ở nhóm 150 mg, ở 13 người (17%) ở nhóm 300 mg và ở 12 người (16%) ở nhóm dùng giả dược nhóm (Bảng 1). Tất cả những người tham gia đều có kết quả xét nghiệm máu âm tính vào ngày sử dụng L9LS hoặc giả dược. Tính đại diện của những người tham gia thử nghiệm được mô tả trong Bảng 8.
⚠️SỰ AN TOÀN của TNLS
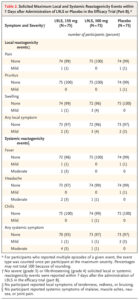
📌Trong số những người lớn tham gia pha A, 3 trong 6 (50%) người nhận được 300 mg L9LS và một trong sáu người (17%) người nhận được 600 mg L9LS bị sưng nhẹ, thoáng qua tại chỗ tiêm.
Không có tác dụng phụ nào khác được quan sát thấy trong vòng 7 ngày sau khi dùng L9LS (Bảng 3). Trong thời gian nghiên cứu 28 tuần, không có tác dụng phụ nghiêm trọng nào được báo cáo và tất cả các tác dụng phụ không mong muốn xảy ra đều ở mức độ 1 hoặc 2 và được giải quyết mà không cần can thiệp (Bảng 5).
📌Trong số những trẻ em ở pha A, không có sự kiện gây phản ứng cục bộ hoặc toàn thân nào được ghi nhận trong vòng 7 ngày sau khi dùng L9LS (Bảng 4).
Không có tác dụng phụ nghiêm trọng nào được quan sát thấy trong thời gian thử nghiệm 28 tuần và tất cả các tác dụng phụ không mong muốn xảy ra đều ở mức độ 1 hoặc 2, ngoại trừ một trường hợp tăng bạch cầu cấp độ 4 xảy ra ở một người tham gia 19 ngày sau khi nhận 150 mg của L9LS (Bảng 6); sự kiện này được giải quyết mà không cần can thiệp và được coi là không liên quan đến L9LS trong các cuộc điều tra mù. Người tham gia này không có triệu chứng hoặc phát hiện đáng chú ý nào khi khám thực thể, và các xét nghiệm và chụp X quang khác đều không có gì đáng chú ý.
📌Ở pha B, các tác dụng phụ tại chỗ và toàn thân được nêu ra trong vòng 7 ngày sau khi dùng L9LS hoặc giả dược là không phổ biến, ở mức độ nghiêm trọng từ nhẹ đến trung bình, có tần suất tương tự giữa các nhóm thử nghiệm và được giải quyết mà không cần can thiệp (Bảng 2).
Trong thử nghiệm kéo dài 24 tuần, đã quan sát thấy 108 tác dụng phụ không mong muốn ở cấp độ 1 và 701 tác dụng phụ không mong muốn ở cấp độ 2 (Bảng S7) và không có tác dụng phụ nghiêm trọng nào xảy ra.
🚩HIỆU QUẢ
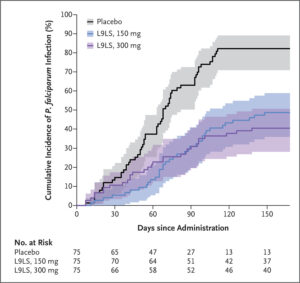
Trong thử nghiệm về hiệu quả (pha B), trong số 225 người tham gia được đưa vào nhóm dân số có chủ đích điều trị đã được sửa đổi (bằng với nhóm có chủ đích điều trị), nhiễm P. falciparum khởi phát từ tuần 1 đến tuần tuần 24 sau khi dùng thuốc xảy ra ở 36 người tham gia (48%) nhận được liều L9LS 150 mg, 30 người (40%) nhận được liều L9LS 300 mg và 61 người (81%) nhận được giả dược.
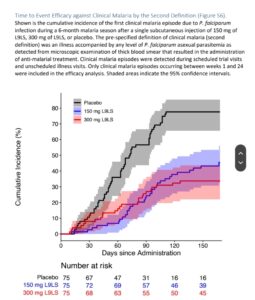
📌Trong phân tích hiệu quả dựa trên thời gian xảy ra lần nhiễm P. falciparum đầu tiên trong thời gian thử nghiệm 24 tuần, hiệu quả của liều L9LS 150 mg so với giả dược là 66% (khoảng tin cậy đã điều chỉnh 95% [CI ], 45 đến 79; P<0,001) và hiệu quả của liều L9LS 300 mg so với giả dược là 70% (CI 95% đã điều chỉnh, 50 đến 82; P <0,001) (Hình 2).
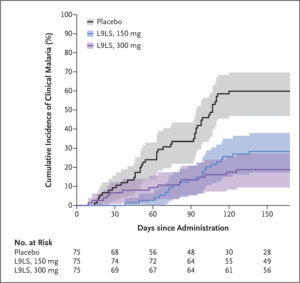
📌Sốt rét lâm sàng (định nghĩa 1) khởi phát từ tuần 1 đến tuần 24 sau khi dùng thuốc xảy ra ở 21 người tham gia (28%) nhận được liều L9LS 150 mg, ở 14 người (19%) nhận được liều L9LS 300 mg, và ở 44 (59%) người dùng giả dược.
Trong phân tích hiệu quả dựa trên thời gian đến đợt sốt rét lâm sàng đầu tiên trong thời gian thử nghiệm 24 tuần, hiệu quả của liều L9LS 150 mg so với giả dược là 67% (KTC điều chỉnh 95%, 39 đến 39). 82; P<0,001) và hiệu quả của liều L9LS 300 mg so với giả dược là 77% (CI 95% đã điều chỉnh, 55 đến 89; P<0,001) (Hình 3).
📌Nguy cơ nhiễm sốt rét và sốt rét lâm sàng là tương tự ở nhóm dùng L9LS 300 mg và nhóm dùng giả dược trong 28 ngày đầu tiên của thử nghiệm (Hình 2 và Hình 3). Một phân tích hậu kiểm về dược động học của L9LS đến ngày thử nghiệm thứ 28 cho thấy rằng khả dụng sinh học L9LS giảm không phải là nguyên nhân gây ra nhiễm trùng sớm ở nhóm dùng 300 mg (Hình S2). Một phân tích kiểu gen post hoc về nhiễm trùng P. falciparum cho đến ngày thử nghiệm 28 cho thấy rằng nhiễm trùng tái phát sau khi sử dụng artemether–lumefantrine khi tuyển sinh đã xảy ra ở một số người tham gia (Hình S3). Nhiễm trùng được phát hiện ở thời điểm nạp bằng xét nghiệm định lượng chuỗi polymerase sao chép ngược (qRT-PCR) ở 18 người tham gia (24%) đã nhận được liều L9LS 150 mg, ở 29 người (39%) đã nhận được liều L9LS. liều L9LS 300 mg và ở 27 người (36%) dùng giả dược.
📌Trong số 22 người tham gia được phát hiện nhiễm trùng qua phết máu từ ngày 7 đến ngày 28, nhiễm trùng cũng được phát hiện bằng xét nghiệm qRT-PCR khi tuyển chọn 4 trong số 4 người tham gia (100%) trong nhóm 150 mg, trong 5 người trong số 8 (62%) ở nhóm dùng 300 mg và 7 trên 10 (70%) ở nhóm giả dược.
📌Nhiễm P. falciparum xảy ra ở 36 người tham gia (48%) ở nhóm 150 mg, ở 30 (40%) ở nhóm 300 mg và ở 61 (81%) ở nhóm nhóm giả dược.
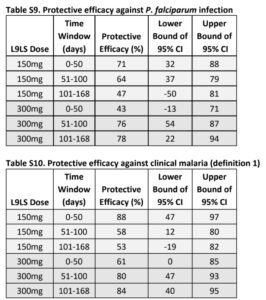
📌Hiệu quả của L9LS chống lại nhiễm trùng P. falciparum, so với giả dược, là 66% (khoảng tin cậy đã điều chỉnh [KTC 95%], 45 đến 79) với liều 150 mg và 70% (KTC 95% đã điều chỉnh, 50 đến 82). ) với liều 300 mg (P <0,001 cho cả hai so sánh).
📌Hiệu quả chống sốt rét lâm sàng là 67% (KTC điều chỉnh 95%, 39 đến 82) với liều 150 mg và 77% (KTC điều chỉnh 95%, 55 đến 89) với liều 300 mg (P<0,001 cho cả hai so sánh).







🍁Bàn luận
Các tác giả nhận thấy rằng một liều L9LS tiêm dưới da mang lại hiệu quả bảo vệ lên tới 70% chống lại nhiễm trùng P. falciparum và lên tới 77% chống lại bệnh sốt rét lâm sàng ở trẻ em từ 6 đến 10 tuổi trong mùa sốt rét kéo dài 6 tháng, trong đó 81 % số người tham gia nhóm giả dược bị nhiễm P.falciparum và 59% mắc bệnh sốt rét lâm sàng.
Việc mở rộng quy mô phòng ngừa bằng kháng thể ngừa sốt rét ở trẻ em dưới 6 tuổi có liên quan đến tỷ lệ mắc bệnh sốt rét cao hơn ở trẻ em trong độ tuổi đi học, có thể do khả năng miễn dịch bị chậm lại. Tiêm vắc-xin RTS cho trẻ nhỏ, Vắc xin S/AS01 hoặc R21/Matrix-M có thể tiếp tục chuyển gánh nặng bệnh sốt rét sang trẻ lớn hơn.
Hơn nữa, trẻ em trong độ tuổi đi học là nguồn lây nhiễm chính và lây truyền sang muỗi. Do phương pháp phòng ngừa bằng miễn dịch thụ động không được sử dụng rộng rãi trong trường học – ở trẻ em trong độ tuổi và không đủ điều kiện tiêm vắc xin RTS, S/AS01 hoặc R21/Matrix-M, dữ liệu từ thử nghiệm của chúng tôi ủng hộ việc sử dụng một liều L9LS duy nhất ở trẻ em trong độ tuổi đi học trước mùa sốt rét như một phương pháp tiếp cận hướng tới việc có thể giảm bớt gánh nặng bệnh tật ở nhóm dân số dễ tiếp cận này.
📌Nguy cơ nhiễm P. falciparum và sốt rét lâm sàng là tương tự nhau ở nhóm dùng L9LS 300 mg và nhóm dùng giả dược trong những tuần đầu thử nghiệm.
Nhóm NC đưa ra giả thuyết rằng các trường hợp nhiễm trùng sporozoite mới có thể xảy ra trước khi L9LS đạt nồng độ tối đa trong huyết thanh khoảng 7 ngày sau khi dùng, dẫn đến các trường hợp nhiễm trùng có thể được phát hiện trên phết máu từ 7 đến 21 ngày sau đó.
Tỷ lệ nhiễm trùng sớm ở nhóm dùng 300 mg cao hơn so với nhóm 150 mg có thể liên quan đến tỷ lệ nhiễm trùng dưới ngưỡng kính hiển vi cơ bản cao hơn ở nhóm dùng 300 mg, vì nhiễm trùng dưới ngưỡng phát hiện của kính hiển vi là dấu hiệu của nguy cơ tái nhiễm cao hơn và nguyên nhân gây nhiễm trùng tái phát ở một số người. Các thử nghiệm trong tương lai có thể đánh giá hiệu quả của việc sử dụng L9LS với thuốc chống sốt rét để giảm thiểu nguy cơ nhiễm trùng sớm và nhiễm trùng từ trước, đặc biệt ở những khu vực có tỷ lệ lây truyền cao.
📌Kết quả của thử nghiệm này hỗ trợ sự phát triển của kháng thể đơn dòng chống sốt rét ở các nhóm dân số có nguy cơ cao khác mà WHO khuyến nghị điều trị dự phòng bằng hóa chất, bao gồm trẻ sơ sinh và trẻ nhỏ, trẻ bị thiếu máu nặng sau khi xuất viện và người mang thai. L9LS có thể bổ sung hoặc thay thế biện pháp phòng ngừa bằng hóa chất để cải thiện phạm vi bao phủ ở những nhóm dân cư này.
Một thử nghiệm giai đoạn 2 ở Kenya liên quan đến trẻ em từ 5 tháng đến 5 tuổi đang đánh giá hiệu quả của việc tiêm L9LS dưới da đối với sự lây truyền lâu năm (số ClinicicalTrials.gov, NCT05400655) và một thử nghiệm giai đoạn 2 ở Mali đang đánh giá hiệu quả của việc tiêm dưới da của L9LS ở phụ nữ trong độ tuổi sinh đẻ (NCT05816330), trước các thử nghiệm trong thai kỳ.
Việc sử dụng kháng thể đơn dòng chống sốt rét cần được xem xét trong bối cảnh triển khai vắc xin RTS, S/AS01 và R21/Matrix-M. Một thử nghiệm gần đây cho thấy rằng việc phòng ngừa bằng hóa chất sốt rét theo mùa cộng với việc tăng cường RTS,S/AS01 hàng năm cho đến 5 tuổi (sau khi loạt vắc-xin ba liều đầu tiên được bắt đầu lúc 5 đến 17 tháng tuổi) dẫn đến nguy cơ mắc bệnh sốt rét thấp hơn so với hoặc chỉ can thiệp. Do việc miễn dịch dự phòng sốt rét theo mùa bao gồm ít nhất bốn đợt điều trị hàng tháng mỗi năm, nên chiến lược kết hợp trị dự phòng sốt rét theo mùa với tiêm vắc xin tăng cường hàng năm sẽ cần hơn 20 lần chăm sóc sức khỏe cho đến 5 tuổi. Do đó, việc so sánh chiến lược này với một liều L9LS hàng năm, chỉ cần 5 lần liên hệ chăm sóc sức khỏe cho đến 5 tuổi, có thể được quan tâm.
🍁KẾT LUẬN
Tiêm L9LS dưới da cho trẻ em có tác dụng bảo vệ khỏi nhiễm P. falciparum và sốt rét lâm sàng trong thời gian 6 tháng.
NC được tài trợ bởi National Institute of Allergy and Infectious Diseases; ClinicalTrials.gov number, NCT05304611.
Long Tran dịch.